Enhancer-FACS-seq
Enhancer-FACS-seq ( eFS ), utvecklad av Bulyk-labbet vid Brigham and Women's Hospital och Harvard Medical School , är en mycket parallell förstärkaranalys som syftar till identifiering av aktiva, vävnadsspecifika transkriptionsförstärkare, i samband med hel Drosophila melanogaster embryon. Denna teknologi ersätter användningen av mikroskopi för att screena för vävnadsspecifika förstärkare med fluorescensaktiverad cellsortering ( FACS ) av dissocierade celler från hela embryon, kombinerat med identifiering genom Illumina - sekvensering med hög genomströmning.
Introduktion
Transkriptionsreglering
Hos metazoer behöver en eukaryot cell ett specifikt och koordinerat genuttrycksprogram, för att kunna reagera på miljöstress, differentiera ordentligt och utvecklas normalt genom cellcykeln, som involverar den mycket reglerade transkriptionen av tusentals gener. Denna genreglering kontrolleras till stor del, på ett vävnadsspecifikt sätt, av bindningen av transkriptionsfaktorer till icke-kodande genomiska regioner som kallas cis-regulatoriska moduler (CRM), aktiverar eller undertrycker genuttryck genom att modulera strukturen av kromatin och har därför en positiv eller negativ effekt på transkriptionsreglering . CRM som aktiverar genuttryck kallas ofta transkriptionella förstärkare , medan de som undertrycker genuttryck kallas transkriptionella ljuddämpare .
Enhancer detektion i Drosophila melanogaster
Trots att det är en kraftfull modellorganism för biologi och studier av transkriptionella förstärkare, har den vävnadsspecifika aktiviteten för mindre än 5% av de uppskattade 50 000 transkriptionsförstärkarna i Drosophila melanogaster upptäckts. Under det senaste decenniet var den huvudsakliga metoden för att detektera vävnads- eller celltypspecifika aktiviteter av förstärkare i Drosophila melanogaster att testa kandidatförstärkare med traditionella reporteranalyser, som är lågkapacitet och kostsamma. Under de senaste åren, även om upptäckten av förstärkare har förbättrats och andra parallella reporteranalyser har utvecklats, har ingen hittills tillåtit direkt identifiering av förstärkaraktivitet i ett genomiskt sammanhang i celltyper av intresse i ett helt embryo.
Metodik
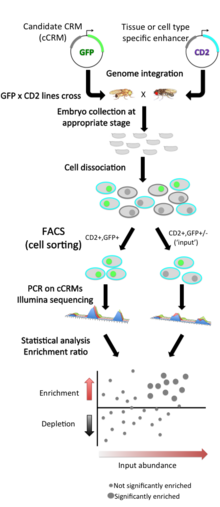
Varje CRM-kandidat (cCRM) klonas uppströms om en reportergen . Jämfört med traditionella reporteranalyser är den främsta innovationen användningen av fluorescensaktiverad cellsortering (FACS) av dissocierade celler, istället för mikroskopi, för att screena efter vävnadsspecifika förstärkare. Detta tillvägagångssätt använder ett tvåmarkörssystem: i varje embryo används en markör (här, rått- CD2 -cellytproteinet) för att märka celler i en specifik vävnad för att sorteras efter FACS, och den andra markören (här grönt fluorescerande protein) GFP ) används som reporter av CRM-aktivitet.
Celler sorteras enligt deras vävnadstyp och sedan genom GFP- fluorescens , och cCRM:erna återvinns genom PCR från dubbelpositiva sorterade celler och från totala ingångsceller. Högkapacitetssekvensering av båda populationerna gör det sedan möjligt att mäta den relativa förekomsten av varje cCRM i input och sorterade populationer; man kan sedan bedöma anrikningen eller utarmningen av varje cCRM i dubbelpositiva celler kontra input som ett mått på aktivitet i den CD2-positiva celltyp som testas.
Betydande resultat
I den första rapporten om denna metod drogs ett bibliotek med ~500 cCRM från en mängd olika genomiska datakällor (t.ex. TF-bundna regioner, koaktivatorbundna regioner, DNas I-överkänsliga platser och förutsägelser från Bulyk-labbets PhylCRM- algoritm ) genom PCR från genomiskt DNA och screenades sedan för aktivitet i embryonala mesoderm och i specifika mesodermala celltyper. Resultaten validerades genom traditionell reportergenanalys i Drosophila melanogaster- embryon för 68 cCRMs testade av eFS. Specificiteten för eFS var utmärkt bland signifikant berikade cCRMs, medan känsligheten var god där majoriteten av de CD2-positiva cellerna uttrycker GFP. Det visade sig att de kända förstärkarassocierade kromatinmärkena H3K27ac , H3K4me1 och Pol II är signifikant berikade bland de förstärkare som visat sig vara aktiva i mesoderm .
Fördelar och framtida tillämpningar
Fördelar med eFS
- Mycket parallell identifiering av aktiva, vävnadsspecifika transkriptionsförstärkare i hela embryon
- Aktivitet för kandidatförstärkare analyserad i ett genomiskt sammanhang
- Hög specificitet av detekterade förstärkare
Framtida applikationer
eFS-analysen kan användas för att analysera andra cell- eller vävnadstyper. Genom att bedöma anrikning i GFP-uttryckande CD2-negativa såväl som CD2-positiva celler, och genom att korsa en gemensam pool av reportertransformanta hanflugor till honor som uttrycker CD2 i olika celltyper, är det möjligt att analysera specificitet såväl som aktivitet. Att accelerera annoteringen av det regulatoriska genomet i Drosophila borde i princip generera den typ av storskalig regulatorisk interaktionsdata som skulle göra det möjligt att utforska nätverksegenskaperna för transkriptionell reglering.