Cystinknut
| Cystin-knutdomän | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
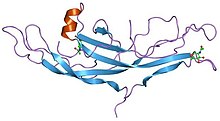 Struktur av humant koriongonadotropin.
| |||||||||||
| Identifierare | |||||||||||
| Symbol | Cys_knot | ||||||||||
| Pfam | PF00007 | ||||||||||
| Pfam klan | CL0079 | ||||||||||
| InterPro | IPR006208 | ||||||||||
| SCOP2 | 1hcn / SCOPe / SUPFAM | ||||||||||
| |||||||||||
En cystinknut är ett proteinstrukturmotiv som innehåller tre disulfidbryggor (bildade av par av cysteinrester ). Sektionerna av polypeptid som uppstår mellan två av dem bildar en slinga genom vilken en tredje disulfidbindning passerar och bildar en rotaxansubstruktur . Cystinknutmotivet stabiliserar proteinstrukturen och bevaras i proteiner över olika arter. Det finns tre typer av cystinknut, som skiljer sig åt i disulfidbindningarnas topologi:
- Tillväxtfaktor cystinknuten (GFCK)
- inhibitor cystin knot (ICK) vanlig hos spindel- och snigelgifter
- Cyklisk cystinknut eller cyklotid
Tillväxtfaktorcystinknuten observerades först i strukturen av nervtillväxtfaktor (NGF), löst genom röntgenkristallografi och publicerad 1991 av Tom Blundell i Nature . GFCK finns i fyra superfamiljer. Dessa inkluderar nervtillväxtfaktor, transformerande tillväxtfaktor beta (TGF-β), blodplättshärledd tillväxtfaktor och glykoproteinhormoner inklusive humant koriongonadotropin . Dessa är strukturellt relaterade på grund av närvaron av cystinknutmotivet men skiljer sig i sekvens. Alla GFCK-strukturer som har bestämts är dimera, men deras dimeriseringssätt i olika klasser är olika. Den vaskulära endotelial tillväxtfaktor- underfamiljen, kategoriserad som en del av den blodplättshärledda tillväxtfaktor-superfamiljen, inkluderar proteiner som är angiogena faktorer.
Närvaron av motivet cyklisk cystinknut (CCK) upptäcktes när cyklotider isolerades från olika växtfamiljer. CCK-motivet har en cyklisk ryggrad, trippelsträngat beta-ark och cystinknutkonformation.
Nya proteiner läggs till i cystinknutmotivfamiljen, även känd som C-terminal cystinknut (CTCK)-proteiner. De delar ungefär 90 aminosyrarester i sina cysteinrika C-terminala regioner.
Inhibitor cystine knot (ICK) är ett strukturellt motiv med ett trippelsträngat antiparallellt beta-ark sammanlänkat med tre disulfidbindningar, som bildar en knuten kärna. ICK-motivet finns under kategorin phylum , såsom djur och växter. Det finns ofta i många giftpeptider som sniglar, spindlar och skorpioner. Peptid K-PVIIA, som innehåller en ICK, kan genomgå en framgångsrik enzymatisk ryggradscyklisering . Disulfidkopplingen och det gemensamma sekvensmönstret för ICK-motivet ger stabiliteten hos peptiderna som stöder cyklisering.
Drogimplikationer
Stabiliteten och strukturen hos cystinknutmotivet implicerar möjliga tillämpningar i läkemedelsdesign . Vätebindningen mellan motivets disulfidbindningar och beta-arkstrukturerna ger upphov till högeffektiv strukturstabilisering . Dessutom är storleken på motivet cirka 30 aminosyrarester. Dessa två egenskaper gör den till en attraktiv biomolekyl att användas för läkemedelstillförsel eftersom den uppvisar termisk stabilitet, kemisk stabilitet och proteolytisk resistens. De biologiska aktiviteterna hos dessa molekyler beror delvis på det unika sammanlåsningsarrangemanget och den cykliserade peptidryggraden som innehåller en konserverad sekvens som delas mellan cirkuliner. Cirkuliner har tidigare identifierats i en screening för anti-HIV-aktivitet. Studier har visat att cystinknutproteiner kan inkuberas vid temperaturer på 65 °C eller placeras i 1 N HCl/1N NaOH utan förlust av strukturell och funktionell integritet. Dess resistens från orala och vissa intestinala proteaser tyder på möjlig användning för oral leverans. Möjliga framtida tillämpningar inkluderar smärtlindring samt antivirala och antibakteriella funktioner.