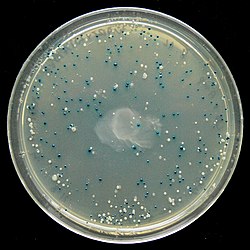
Blå-vit skärm
Den blå-vita skärmen är en screeningsteknik som möjliggör snabb och bekväm detektering av rekombinanta bakterier i vektorbaserade molekylära kloningsexperiment . Denna metod för screening utförs vanligtvis med användning av en lämplig bakteriestam , men andra organismer såsom jäst kan också användas. Transformationens DNA ligeras in i en vektor . Vektorn infogas sedan i en kompetent värdcell som är livsduglig för transformation, som sedan odlas i närvaro av X-gal . Celler transformerade med vektorer innehållande rekombinant DNA kommer att producera vita kolonier; celler transformerade med icke-rekombinanta plasmider (dvs endast vektorn) växer till blå kolonier.
Bakgrund
Molekylär kloning är en av de mest använda metoderna inom molekylärbiologi . En gen av intresse kan infogas i en plasmidvektor via ligering , och plasmiden transformeras sedan in i Escherichia coli- celler. Emellertid kan inte alla plasmider som transformerats till celler innehålla den önskade geninsättningen, och att kontrollera varje enskild koloni för närvaron av insättningen är tidskrävande. Därför skulle en metod för detektering av insatsen vara användbar för att göra denna procedur mindre tids- och arbetskrävande. En av de tidiga metoderna som utvecklats för att detektera insert är blå-vit screening som möjliggör identifiering av framgångsrika produkter från kloningsreaktioner genom färgen på bakteriekolonin .
Metoden bygger på principen om α-komplementering av β-galaktosidasgenen . Detta fenomen av α-komplementering demonstrerades först i arbete utfört av Agnes Ullmann i laboratoriet av François Jacob och Jacques Monod , där funktionen hos ett inaktivt mutant β-galaktosidas med deleterad sekvens visade sig räddas av ett fragment av β-galaktosidas där samma sekvens, a-donatorpeptiden, fortfarande är intakt. Langley et al. visade att det mutanta icke-funktionella β-galaktosidaset delvis saknades i sin N-terminal med dess rester 11-41 deleterade, men det kan kompletteras med en peptid bildad av resterna 3-90 av β-galaktosidas. M13 filamentös fag innehållande sekvens som kodar för de första 145 aminosyrorna konstruerades senare av Messing et al. och a-komplementering via användning av en vektor visades genom bildandet av blå plack när celler innehållande det inaktiva proteinet infekterades av fagen och sedan odlades i plattor innehållande X-gal.
pUC-serien av plasmidkloningsvektorer av Vieira och Messing utvecklades från M13-systemet och var de första plasmiderna som konstruerades för att dra fördel av denna screeningsmetod. I denna metod stör DNA som ligerats in i plasmiden α-peptiden och därför komplementeringsprocessen, och inget funktionellt β-galaktosidas kan bildas. Celler transformerade med plasmid som innehåller en insert bildar därför vita kolonier, medan celler transformerade med plasmid utan insert bildar blå kolonier; Resultatet av en framgångsrik ligering kan således lätt identifieras genom den vita färgen av celler som bildas från de misslyckade blå.
Molekylär mekanism
β-galaktosidas är ett protein som kodas av lacZ- genen från lac- operonet , och det existerar som en homotetramer i sitt aktiva tillstånd. Emellertid har ett mutant β-galaktosidas härlett från M15-stammen av E. coli sina N-terminala rester 11-41 deleterade och denna mutant, ω-peptiden, kan inte bilda en tetramer och är inaktiv. Denna mutanta form av protein kan emellertid återgå helt till sitt aktiva tetramera tillstånd i närvaro av ett N-terminalt fragment av proteinet, a-peptiden. Räddningen av funktionen hos mutant β-galaktosidas av α-peptiden kallas α-komplementering.
bär värd- E. coli -stammen lacZ- deletionsmutanten ( lacZΔM15 ) som innehåller ω-peptiden, medan de använda plasmiderna bär lacZα -sekvensen som kodar för de första 59 resterna av β-galaktosidas, α-peptiden . Ingen av dem är funktionell i sig. Men när de två peptiderna uttrycks tillsammans, som när en plasmid som innehåller lacZa- sekvensen transformeras till en lacZAM15 -cell, bildar de ett funktionellt p-galaktosidasenzym .
Den blå-vita screeningmetoden fungerar genom att störa denna α-komplementeringsprocessen. Plasmiden bär inom lacZa- sekvensen ett internt multipelkloningsställe (MCS). Denna MCS i lacZa- sekvensen kan skäras av restriktionsenzymer så att det främmande DNA:t kan infogas i lacZa -genen och därigenom störa genen som producerar a-peptid. Följaktligen kan inget funktionellt p-galaktosidas bildas i celler som innehåller plasmiden med en insättning.
Närvaron av ett aktivt β-galaktosidas kan detekteras av X-gal , en färglös analog av laktos som kan klyvas av β-galaktosidas för att bilda 5-brom-4-kloro-indoxyl, som sedan spontant dimeriserar och oxiderar för att bilda en klarblått olösligt pigment 5,5'-dibrom-4,4'-diklor-indigo. Detta resulterar i en karakteristisk blå färg i celler som innehåller ett funktionellt p-galaktosidas. Blå kolonier visar därför att de kan innehålla en vektor med en oavbruten lacZα (därför ingen insättning), medan vita kolonier, där X-gal inte hydrolyseras, indikerar närvaron av ett insert i lacZα som stör bildningen av ett aktivt β-galaktosidas .
De rekombinanta klonerna kan analyseras ytterligare genom att isolera och rena små mängder plasmid-DNA från de transformerade kolonierna och restriktionsenzymer kan användas för att klippa klonen och bestämma om den har fragmentet av intresse. Om DNA är nödvändigt för att sekvenseras, kommer plasmiderna från kolonierna att behöva isoleras vid en punkt, vare sig det ska skäras med restriktionsenzymer eller utföra andra analyser.
Praktiska överväganden
Rätt typ av vektor och kompetenta celler är viktiga överväganden när du planerar en blå-vit skärm. Plasmiden måste innehålla lacZa , och exempel på sådana plasmider är pUC19 och pBluescript. E. coli- cellen bör innehålla den muterade lacZ- genen med deleterad sekvens (dvs lacZΔM15 ), och några av de vanligen använda cellerna med sådan genotyp är JM109, DH5a och XL1-Blue. Det bör också förstås att lac-operonet påverkas av närvaron av glukos. Proteinet EIIA Glc , som är involverat i glukosimport, stänger av laktospermeas när glukos transporteras in i cellen. Mediet som används i agarplattan bör därför inte innehålla glukos.
X-gal är ljuskänslig och därför bör dess lösning och plattor som innehåller X-gal förvaras mörkt. Isopropyl β-D-1-tiogalaktopyranosid (IPTG), som fungerar som induceraren av lac -operonet, kan användas i media för att öka uttrycket av LacZ.
X-gal är ett dyrt material, därför har andra metoder utvecklats för att screena bakterier. GFP har utvecklats som ett alternativ för att hjälpa till att screena bakterier. Konceptet liknar α-komplementering där en DNA-insättning kan störa den kodande sekvensen i en vektor och därmed störa GFP-produktionen vilket resulterar i icke-fluorescerande bakterier. Bakterier som har rekombinanta vektorer (vektor + insert), kommer att vara vita och inte uttrycka GFP-proteinet, medan icke-rekombinanta (vektor) kommer och fluorescerar under UV-ljus. GFP i allmänhet har använts som en reportergen där individer definitivt kan avgöra om en klon bär på en gen som forskare analyserar. Ibland kan mediet som kolonierna växer i påverka skärmen och introducera falskt positiva resultat. X-gal på mediet kan ibland brytas ned för att producera en blå färg eller så kan GFP förlora sin fluorescens på grund av mediet och kan påverka forskarnas förmåga att bestämma kolonier med önskan rekombinant och de som inte har det.
Nackdelar
Vissa vita kolonier kanske inte innehåller den önskade rekombinanta plasmiden av ett antal skäl. Det ligerade DNA:t kanske inte är det korrekta eller inte korrekt ligerat, och det är möjligt för någon linjäriserad vektor att transformeras, dess ändar "repareras" och ligeras samman så att ingen LacZa produceras och inga blå kolonier kan bildas. Mutation kan också leda till att a-fragmentet inte uttrycks. En koloni utan vektor alls kommer också att se vit ut, och kan ibland visas som satellitkolonier efter att antibiotikan som används har utarmats. Det är också möjligt att blå kolonier kan innehålla insatsen. Detta inträffar när insättningen är "i ram" med LacZα-genen och ett STOPP-kodon saknas i insättningen. Detta kan leda till uttryck av ett fusionsprotein som har en funktionell LacZα om dess struktur inte störs. Den korrekta rekombinanta konstruktionen kan ibland ge ljusare blå kolonier vilket kan komplicera dess identifiering.