Självmordsgen
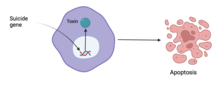
Inom genetikområdet är en självmordsgen en gen som kommer att få en cell att döda sig själv genom processen med apoptos ( programmerad celldöd). Aktivering av en självmordsgen kan orsaka död genom en mängd olika vägar, men en viktig cellulär "switch" för att inducera apoptos är p53 -proteinet. Stimulering eller introduktion (genom genterapi ) av självmordsgener är ett potentiellt sätt att behandla cancer eller andra proliferativa sjukdomar.
Självmordsgener utgör grunden för en strategi för att göra cancerceller mer sårbara eller känsliga för kemoterapi . Tillvägagångssättet har varit att fästa delar av gener som uttrycks i cancerceller till andra gener för enzymer som inte finns i däggdjur som kan omvandla ett ofarligt ämne till ett som är giftigt för tumören . De flesta självmordsgener medierar denna känslighet genom att koda för virala eller bakteriella enzymer som omvandlar ett inaktivt läkemedel till toxiska antimetaboliter som hämmar syntesen av nukleinsyra. Självmordsgener måste införas i cellerna på ett sätt som säkerställer deras upptag och uttryck av så många cancerceller som möjligt, samtidigt som de begränsar deras uttryck av normala celler. Självmordsgenterapi för cancer kräver att vektorn har kapacitet att skilja mellan målceller och icke-målceller, mellan cancercellerna och normala celler.
Apoptos
Celldöd kan huvudsakligen inträffa antingen genom nekros eller apoptos . Nekros uppstår när en cell skadas av en yttre kraft, såsom gift, en kroppsskada, en infektion eller att bli avskuren från blodtillförseln. När celler dör av nekros är det en ganska rörig affär. Dödsfallet orsakar inflammation som kan orsaka ytterligare ångest av skada i kroppen. Medan apoptos orsakar nedbrytning av cellulära komponenter utan att framkalla ett inflammatoriskt svar.
Många celler genomgår programmerad celldöd, eller apoptos, under fosterutvecklingen. En form av celldöd där ett programmerat händelseförlopp leder till eliminering av celler utan att släppa ut skadliga ämnen i omgivningen. Apoptos spelar en avgörande roll för att utveckla och bibehålla kroppens hälsa genom att eliminera gamla celler, onödiga celler och ohälsosamma celler. Människokroppen ersätter kanske en miljon celler per sekund. När en cell tvingas begå självmord, agerar proteiner som kallas kaspaser . De bryter ner de cellulära komponenterna som behövs för att överleva, och de stimulerar produktionen av enzymer som kallas DNas, som förstör DNA i cellkärnan. Cellen krymper och skickar ut nödsignaler, som besvaras av makrofager . Makrofagerna rensar bort de krympta cellerna och lämnar inga spår, så dessa celler skadar inte omgivande nekrotiska celler. Apoptos är också avgörande för prenatal utveckling . Till exempel, i embryon, är fingrar och tår initialt kopplade till intilliggande siffror av vävnad. Cellerna i denna bindväv genomgår apoptos för att producera separata siffror. I hjärnans utveckling skapas initialt miljontals extra neuroner. De celler som inte bildar synaptiska förbindelser genomgår apoptos. Programmerad celldöd är också nödvändig för att starta menstruationsprocessen. Därmed inte sagt att apoptos är en perfekt process. Istället för att dö på grund av skada dör celler som går igenom apoptos som svar på signaler i kroppen. När celler känner igen virus och genmutationer kan de framkalla död för att förhindra att skadan sprids. Forskare försöker lära sig hur de kan modulera apoptos, så att de kan kontrollera vilka celler som lever och vilka som genomgår programmerad celldöd. Anticancerläkemedel och strålning verkar till exempel genom att utlösa apoptos i sjuka celler. Många sjukdomar och störningar är kopplade till cellers liv och död – ökad apoptos är ett kännetecken för AIDS, Alzheimers och Parkinsons sjukdom, medan minskad apoptos kan signalera lupus eller cancer. Att förstå hur man reglerar apoptos kan vara det första steget för att behandla dessa tillstånd.
För lite eller för mycket apoptos kan spela en roll vid många sjukdomar. När apoptos inte fungerar korrekt kan celler som bör elimineras kvarstå och bli odödliga, till exempel vid cancer och leukemi. när apoptos fungerar för bra dödar den för många celler och orsakar allvarlig vävnadsskada. Detta är fallet vid stroke och neurodegenerativa sjukdomar som Alzheimers, Huntingtons och Parkinsons sjukdom. Även känd som programmerad celldöd och cellsjälvmord.
Ansökningar
Genterapi för cancersjälvmord
Det slutliga målet med cancerterapi är att fullständigt eliminera alla cancerceller, samtidigt som alla friska celler lämnas oskadda. En av de mest lovande terapeutiska strategierna i detta avseende är cancersjälvmordsgenterapi (CSGT), som snabbt utvecklas mot nya gränser. Den terapeutiska framgången, i CSGT, är i första hand beroende av precision i leveransen av de terapeutiska transgenerna endast till cancercellerna. Detta åtgärdas genom att upptäcka och rikta in sig på unika eller/och överuttryckta biomarkörer som visas på cancercellerna och cancerstamcellerna. Specificiteten för cancerterapeutiska effekter förstärks ytterligare genom att designa DNA-konstruktionerna, som sätter de terapeutiska generna under kontroll av cancercellspecifika promotorer. Leveransen av de suicidala generna till cancercellerna involverar såväl virala som syntetiska vektorer, som styrs av cancerspecifika antikroppar och ligander. Leveransalternativen inkluderar även konstruerade stamceller med tropismer mot cancer. Huvudmekanismer som inducerar cancercellers död inkluderar: transgent uttryck av tymidinkinaser, cytosindeaminaser, intracellulära antikroppar, telomeraser, kaspaser, DNaser. Försiktighetsåtgärder vidtas för att eliminera riskerna i samband med transgenes. Framsteg inom genomik och proteomik bör hjälpa oss att identifiera cancerspecifika biomarkörer och metabola vägar för att utveckla nya strategier för kliniska prövningar av riktad och personlig genterapi av cancer. Genom att introducera genen i en elakartad tumör skulle tumören minska i storlek och eventuellt försvinna helt, förutsatt att alla enskilda celler har fått en kopia av genen.
När DNA-provet i viruset tas från patientens egna friska celler behöver viruset inte kunna skilja på cancerceller och friska. Dessutom är fördelen att den också kan förhindra metastaser vid döden av en tumör.
Som en cancerbehandling
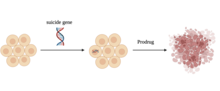
En av utmaningarna med cancerbehandling är hur man förstör maligna tumörer utan att skada friska celler. En ny metod som visar mycket lovande för att åstadkomma detta använder sig av en självmordsgen. En självmordsgen är en gen som gör att en cell dödar sig själv genom apoptos. Självmordsgenterapi innebär leverans av en gen som kodar för en cytotoxisk produkt till tumörceller. Detta kan uppnås genom två tillvägagångssätt, indirekt genterapi och direkt genterapi. Indirekt genterapi använder enzymaktiverad prodrug, där enzymet omvandlar prodrugen till en giftig substans och genen som kodar för detta enzym levereras till tumörcellerna. Till exempel en vanligt studerad strategi baserad på transfektion av herpes simplex-virus tymidinkinas (HSV-TK) tillsammans med administrering av ganciklovir (GSV), där HSK-TK hjälper till att omvandla GCV till en giftig förening som hämmar DNA-syntesen och orsakar celler död. Medan direkt genterapi använder en toxingen eller en gen som har förmågan att korrigera muterade proapoptotiska gener, vilket i sin tur kan inducera celldöd via apoptos. Till exempel är det mest undersökta immunotoxinet för cancerterapi difteritoxinet eftersom det hämmar proteinsyntesen genom att inaktivera förlängningsfaktor 2 (EF-2) som i sin tur hämmar proteinöversättning. Dessutom har p53 identifierats som ofta onormalt i mänskliga tumörer och studier visar att återställande av p53-funktionen kan orsaka apoptos av cancerceller. Självmordsgenterapi förväntas inte nödvändigtvis eliminera behovet av kemoterapi och strålbehandling för alla cancertumörer. Skadan som åsamkas tumörcellerna gör dem dock mer mottagliga för kemoterapi eller strålning. Detta tillvägagångssätt har redan visat sig vara effektivt mot prostatacancer och blåscancer. Tillämpningen av genterapi för självmord utökas även till flera andra cancerformer. Cancerpatienter upplever ofta ett deprimerat immunförsvar, så de kan drabbas av vissa biverkningar av användningen av ett virus som tillförselmedel. [ citat behövs ]
Förbättrade vektorer
Självmordsgenleverans kan brett klassificeras i tre grupper som inkluderar virala vektorer, syntetiska vektorer och cellbaserade vektorer. De mest effektiva vehiklarna för genleverans är virala vektorer. Vanligt använda virus för genterapi inkluderar retrovirus, adenovirus (Ads), lentivirus och Aden-associerade virus (AAV). Icke-virala vektorer som syntetiska vektorer användes för att bekämpa vissa nackdelar med virala vektorer som immunogenicitet, insättningsmutagenes för att nämna några. Syntetiska vektorer hänvisar till användning av nanopartiklar , som guldnanopartiklar, för att leverera gener till målceller. Slutligen använder cellbaserade vektorer stamceller som bärare av självmordsgener. Under de senaste åren patenterades cellmedierad genterapi för cancer med hjälp av mesenkymala stamceller (MSC).
Åskådareffekt
Bystander-effekten (BE) är ett fenomen som ett resultat av vilket det är möjligt att döda otransfekterade tumörceller som ligger intill transducerade celler i självmordsgenterapi. Eftersom hundraprocentig transduktion av alla tumörceller är mycket svår att uppnå, är BE en kritisk del av självmordsgenterapi.
Begränsningar
Läkemedlet är tänkt att visa hög specificitet mot cancer för att vara effektivt, men studier har visat att detta sällan uppnås. Dessutom var uttrycket av självmordsgenen under kontroll av tumörspecifika promotorer som humant telomeras (hTERT), osteokalcin , karcinoembryonalt antigen ; dock visade sig endast hTERT-promotorn gå in i kliniska prövningar. Detta beror främst på den låga transkriptionskraften hos dessa tumörspecifika promotorer för självmordsgenuttryck. Dessutom är dålig tillgänglighet till målceller en viktig begränsning av självmordsgenterapi. Ett annat stort hinder för självmordsgenterapi är partiell vektorspecificitet för att rikta in sig på drabbade celler. Slutligen, brist på specifika djurmodeller för att förutsäga det kliniska resultatet och andra effekter av SGT.
Bioteknik
Självmordsgener används ofta inom bioteknik för att hjälpa till vid molekylär kloning. Vektorer innehåller självmordsgener för en organism (såsom E. coli) . Kloningsprojektet fokuserar på att ersätta självmordsgenen med det önskade fragmentet. Valet av vektorer som bär det önskade fragmentet förbättras eftersom vektorer som behåller självmordsgenen resulterar i celldöd.