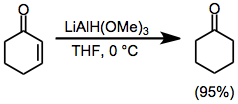
Reduktioner med metallalkoxialuminiumhydrider
Reduktioner med metallalkoxialuminiumhydrider är kemiska reaktioner som involverar antingen nettohydrering av en omättad förening eller ersättning av en reducerbar funktionell grupp med väte med metallalkoxialuminiumhydridereagens.
Introduktion
Natriumborhydrid och litiumaluminiumhydrid används vanligtvis för reduktion av organiska föreningar. Dessa två reagenser är på ytterligheterna av reaktivitet - medan litiumaluminiumhydrid reagerar med nästan alla reducerbara funktionella grupper, reagerar natriumborhydrid med ett mycket mer begränsat antal funktionella grupper . Minskad eller förhöjd reaktivitet kan realiseras genom ersättning av en eller flera av vätena i dessa reagens med alkoxigrupper.
Dessutom möjliggör substitution av väte för kirala alkoxigrupper i dessa reagens asymmetriska reduktioner. Även om metoder som involverar stökiometriska mängder av kirala metallhydrider har ersatts i modern tid av enantioselektiva katalytiska reduktioner, är de av historiskt intresse som tidiga exempel på stereoselektiva reaktioner.
Tabellen nedan sammanfattar de reduktioner som kan utföras med en mängd olika metallaluminiumhydrider och borhydrider. Symbolen "+" indikerar att reduktion inträffar, "-" indikerar att reduktion inte inträffar, "±" indikerar att reduktion beror på strukturen av substratet, och "0" indikerar brist på litteraturinformation.
-
()
Mekanism och stereokemi
Rådande mekanism
Reduktion med alkoxialuminiumhydrider tros i de flesta fall ske genom en polär mekanism. Hydridöverföring till det organiska substratet genererar en organisk anjon, som neutraliseras antingen av protiskt lösningsmedel eller vid sur upparbetning.
-
()
Reduktioner av α,β-omättade karbonylföreningar kan förekomma i en 1,2 mening (direkt addition) eller en 1,4 mening (konjugat addition). Tendensen att addera i 1,4-bemärkelse är korrelerad med hydridreagensens mjukhet enligt Pearsons hård-mjuk syra-bas-teori. Experimentella resultat överensstämmer med teorin - mjukare hydridreagens ger högre utbyten av konjugatreduktionsprodukten.
-
()
Ett fåtal substrat, inklusive diarylketoner, diarylalkener och antracen , är kända för att genomgå reduktion genom enkelelektronöverföringsvägar med litiumaluminiumhydrid.
Metallalkoxylaluminiumhydridreagenser är väl karakteriserade i ett begränsat antal fall. Exakt karakterisering kompliceras i vissa fall av disproportionering, vilket omvandlar alkyoxialuminiumhydrider till alkoxialuminater och metallaluminiumhydrid:
-
LiAlH n (OR) 4- n ⇌ (4- n ) LiAlH 4 + n LiAlH(OR) 4
()
Stereokemi
Ursprunget till diastereoselektivitet i minskningar av kirala ketoner har analyserats och modellerats omfattande. Enligt en modell som utvecklats av Felkin styrs diastereoselektivitet av den relativa energin för de tre övergångstillstånden I , II och III . Övergångstillstånd I gynnas i frånvaro av polära grupper på a-kolet, och stereoselektiviteten ökar när storleken på den akirala ketonsubstituenten (R) ökar. Övergångstillstånd III gynnas för reduktioner av alkylketoner i vilka RM är en elektronbortdragande grupp, eftersom nukleofilen och elektronåterdragande substituenten föredrar att vara så långt borta från varandra som möjligt.
-
()
Diastereoselektivitet i minskningar av cykliska ketoner har också studerats. Konformationellt flexibla ketoner genomgår axiell attack av hydridereagenset, vilket leder till den ekvatoriala alkoholen. Stela cykliska ketoner, å andra sidan, genomgår främst ekvatorial attack för att ge den axiella alkoholen. Preferentiella ekvatorialangrepp på stela ketoner har rationaliserats genom att åberopa "steric approach control" - ett ekvatorialt tillvägagångssätt för hydridereagenset är mindre steriskt hindrat än ett axiellt tillvägagångssätt. Preferensen för axiell attack på konformationellt flexibla cykliska ketoner har behandlats av en modell som lagts fram av Felkin och Anh. Övergångstillståndet för axiell attack ( IV ) lider av sterisk spänning mellan eventuella axiella substituenter och det inkommande hydridreagenset. Övergångstillståndet för ekvatorialangrepp ( V ) lider av vridningstöjning mellan det inkommande hydridreagenset och intilliggande ekvatorialväten. Skillnaden mellan dessa två töjningsenergier bestämmer vilken attackriktning som gynnas, och när R är liten dominerar vridtöjningen i V och den ekvatoriala alkoholprodukten gynnas.
-
()
Omfattning och begränsningar
Alkoxialuminium och närbesläktade hydridreagenser reducerar ett stort antal funktionella grupper , ofta med god selektivitet. Detta avsnitt, organiserat efter funktionell grupp, täcker de vanligaste eller syntetiskt användbara metoderna för alkoxialuminiumhydridreduktion av organiska föreningar .
Många selektiva reduktioner av karbonylföreningar kan åstadkommas genom att dra fördel av de unika reaktivitetsprofilerna hos metallalkoxylaluminiumhydrider. Till exempel reducerar litiumtri- tert -butoxi)aluminiumhydrid (LTBA) aldehyder och ketoner selektivt i närvaro av estrar, med vilka den reagerar extremt långsamt.
-
()
α,β-omättade ketoner kan reduceras selektivt i en 1,2 eller 1,4 mening genom ett klokt val av reduktionsmedel. Användning av relativt obehindrad litiumtrimetoxialuminiumhydrid resulterar i nästan kvantitativ direkt addition till karbonylgruppen (Ekv. ( 9 )). Å andra sidan leder användningen av det skrymmande reagenset LTBA till ett högt utbyte av konjugatadditionsprodukten (Ekv. ( 10 )).
-
()
-
()
Eterklyvning är svår att åstadkomma med de flesta hydridreagenser. Emellertid kan debensylering av bensylaryletrar åstadkommas med SMEAH. Detta protokoll är ett användbart alternativ till metoder som kräver syra eller hydrogenolys (t.ex. Pd/C och vätgas).
-
()
Epoxider angrips i allmänhet av alkoxialuminiumhydrider vid den mindre substituerade positionen. En närliggande hydroxylgrupp kan underlätta intramolekylär leverans av hydridereagenset, vilket möjliggör selektiv öppning av 1,2-disubstituerade epoxider vid positionen närmare hydroxylgruppen. Konfigurationen vid det orörda epoxidkolet bevaras.
-
()
Omättade karbonylföreningar kan reduceras antingen till mättade eller omättade alkoholer med alkoxialuminiumhydridreagens. Tillsats av en omättad aldehyd till en lösning av Red-Al gav den mättade alkoholen; omvänd tillsats gav den omättade alkoholprodukten.
-
()
Alkener genomgår hydroaluminering i närvaro av några alkoxialuminiumhydrider. I en relaterad tillämpning reagerar NaAlH2 ( OCH2CH2OCH3 ) 2 ( natriumbis ( metoxietoxi ) aluminiumdihydrid , SMEAH eller Red-Al ) med zirkonocendiklorid för att ge zirkonocenkloridhydrid (Schwartz's reagens). Alkener genomgår hydrozirkonering i närvaro av detta reagens, vilket ger funktionaliserade produkter efter släckning med en elektrofil.
-
()
Funktionella grupper innehållande heteroatomer andra än syre kan också reduceras till motsvarande kolväten i närvaro av ett alkoxialuminiumhydridreagens. Primära alkylhalider genomgår reduktion till motsvarande alkaner i närvaro av NaAlH(OH)( OCH2CH2OCH3 ) 2 . Sekundära halogenider är mindre reaktiva, men ger alkaner i rimligt utbyte.
-
()
Sulfoxider reduceras till motsvarande sulfider i gott utbyte i närvaro av SMEAH.
-
()
Iminer reduceras av metallalkoxialuminiumhydrider till motsvarande aminer. I exemplet nedan bildas användningen av exoaminen med hög diastereoselektivitet. Selektiviteten för hydridreduktion i detta fall är högre än den för katalytisk hydrering.
-
()
Experimentella förhållanden och procedur
Beredning av hydridereagens
Alkoxialuminiumhydrider framställs typiskt genom behandling av litiumaluminiumhydrid med motsvarande alkohol. Väteutveckling indikerar bildandet av alkoxialuminiumhydridprodukter. Hindrade hydrider som litiumtri-( tert -butoxi)aluminiumhydrid (LTBA) är stabila under långa tidsperioder under inert atmosfär, men litiumtrimetoxialuminiumhydrid (LTMA) genomgår disproportionering och bör användas omedelbart efter beredning. Ren, fast Red-Al är stabil i flera timmar under inert atmosfär och finns kommersiellt tillgänglig som en 70%-ig lösning i toluen under varumärket Vitride eller Synhydrid.
Reduktionsvillkor
Reduktion kan typiskt utföras i en rundbottnad kolv utrustad med en återflödeskylare med torkrör, en kvicksilverförseglad mekanisk omrörare, en termometer, ett kväveinlopp och en extra tratt med en tryckutjämnande sidoarm. De vanligaste lösningsmedlen som används är tetrahydrofuran och dietyleter . Vilket lösningsmedel som än används bör vara vattenfritt och rent. Alkoxialuminiumhydrider bör hållas så torra som möjligt och utgöra en betydande brandrisk, särskilt när ett överskott av hydrid används (väte utvecklas under upparbetning).
Exempel förfarande
-
()
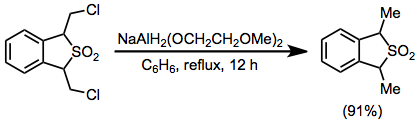
Till en lösning av 1,3-dihydro-1,3-bis(klormetyl)benso[c]tiofen 2,2-dioxid (0,584 g, 2,2 mmol) i 50 ml torr bensen sattes 0,80 ml (2,8 mmol) av en 70% bensenlösning av NaAlH2 ( OCH2CH2OCH2 ) 2 via spruta , och lösningen återloppskokades i 12 timmar . Blandningen kyldes till 0° och sönderdelades med 20% svavelsyra . Bensenskiktet separerades, tvättades med 10 ml vatten, torkades över kaliumkarbonat och koncentrerades för att ge produkten som en gul olja i 91 % utbyte (0,480 g); IR (film) 770, 1140 och 1320 cm–1; NMR (CDCI3 ) 5 4,22 (q, 2 H), 1,61 och 1,59 (2 d, 6 H, J = 7 Hz), 7,3 (s, 4 H); m/e (rel. intensitet) 196 (M+) (14), 132 (M-S02) (100); MS-analys 196,055796 (beräknad), 196,057587 (observerad).