Radikal cyklisering
Radikala cykliseringsreaktioner är organiska kemiska omvandlingar som ger cykliska produkter genom radikala mellanprodukter. De går vanligtvis i tre grundläggande steg: selektiv radikalgenerering, radikal cyklisering och omvandling av den cykliserade radikalen till produkt.
Introduktion
Radikala cykliseringsreaktioner producerar mono- eller polycykliska produkter genom verkan av radikalmellanprodukter. Eftersom de är intramolekylära transformationer är de ofta mycket snabba och selektiva. Selektiv radikalgenerering kan uppnås vid kol bundna till en mängd funktionella grupper , och reagens som används för att åstadkomma radikalgenerering är många. Radikalcykliseringssteget involverar vanligtvis attacken av en radikal på en multipelbindning. Efter att detta steg inträffat släcks de resulterande cykliserade radikalerna genom verkan av en radikalfångare , en fragmenteringsprocess eller en elektronöverföringsreaktion. Fem- och sexledade ringar är de vanligaste produkterna; bildning av mindre och större ringar observeras sällan.
Tre villkor måste uppfyllas för att en effektiv radikal cyklisering ska kunna ske:
- En metod måste finnas tillgänglig för att generera en radikal selektivt på substratet.
- Radikal cyklisering måste gå snabbare än infångning av den initialt bildade radikalen.
- Alla steg måste vara snabbare än oönskade sidoreaktioner såsom radikalrekombination eller reaktion med lösningsmedel.
Fördelar: eftersom radikala intermediärer inte är laddade arter är reaktionsförhållandena ofta milda och funktionell grupptolerans är hög och ortogonal mot den för många polära processer. Reaktioner kan utföras i en mängd olika lösningsmedel (inklusive arener, alkoholer och vatten), så länge som lösningsmedlet inte har en svag bindning som kan genomgå abstraktion, och produkterna är ofta syntetiskt användbara föreningar som kan bäras med hjälp av befintliga funktionalitet eller grupper som introducerats under radikal fångst .
Nackdelar: de relativa hastigheterna för de olika stadierna av radikalcykliseringsreaktioner (och eventuella sidoreaktioner) måste kontrolleras noggrant så att cyklisering och infångning av den cykliserade radikalen gynnas. Sidereaktioner är ibland ett problem, och cyklisering är särskilt långsam för små och stora ringar (även om makrocykliseringar , som liknar intermolekylära radikalreaktioner, ofta ger högt utbyte).
Mekanism och stereokemi
Rådande mekanism
Eftersom det finns många reagens för radikalgenerering och fångst, är det inte möjligt att etablera en enda rådande mekanism. Men när en radikal har genererats kan den reagera med multipla bindningar på ett intramolekylärt sätt för att ge cykliserade radikalintermediärer. De två ändarna av multipelbindningen utgör två möjliga reaktionsställen. Om radikalen i den resulterande intermediären hamnar utanför ringen, kallas attacken "exo"; om den hamnar inne i den nybildade ringen kallas attacken "endo". I många fall gynnas exocyklisering framför endocyklisering (makrocykliseringar utgör det stora undantaget från denna regel). 5-hexenylradikaler är de mest syntetiskt användbara mellanprodukterna för radikalcykliseringar, eftersom cyklisering är extremt snabb och exoselektiv. Även om exo-radikalen är mindre termodynamiskt stabil än endo-radikalen, rationaliseras den snabbare exo-cykliseringen av bättre orbital överlappning i det stolliknande exo-övergångstillståndet (se nedan).
(1)
Substituenter som påverkar stabiliteten för dessa övergångstillstånd kan ha en djupgående effekt på reaktionens platsselektivitet. Karbonylsubstituenter i 2-positionen uppmuntrar till exempel 6-endo-ringslutning. Alkylsubstituenter vid positionerna 2, 3, 4 eller 6 ökar selektiviteten för 5-exo-slutning.
Cyklisering av den homologa 6-heptenylradikalen är fortfarande selektiv, men är mycket långsammare - som ett resultat är kompetitiva sidoreaktioner ett viktigt problem när dessa intermediärer är inblandade. Dessutom kan 1,5-skift ge stabiliserade allylradikaler med jämförbara hastigheter i dessa system. I 6-hexenylradikalsubstrat är polarisering av den reaktiva dubbelbindningen med elektronbortdragande funktionella grupper ofta nödvändig för att uppnå höga utbyten. Att stabilisera den initialt bildade radikalen med elektronbortdragande grupper ger tillgång till mer stabila 6-endocykliseringsprodukter företrädesvis.
(2)
Cykliseringsreaktioner av vinyl-, aryl- och acylradikaler är också kända. Under betingelser av kinetisk kontroll äger 5-exo-cyklisering företrädesvis rum. Låga koncentrationer av en radikalfångare etablerar dock termodynamisk kontroll och ger tillgång till 6-endo-produkter – inte via 6-endo-cyklisering, utan genom 5-exo-cyklisering följt av 3-exo-stängning och efterföljande fragmentering (Dowd-Beckwith omarrangemang). Medan vid höga koncentrationer av exo-produkten snabbt fångas in, vilket förhindrar efterföljande omlagring till endoprodukten Arylradikaler uppvisar liknande reaktivitet.
(3)
Cyklisering kan involvera heteroatominnehållande multipla bindningar såsom nitriler , oximer och karbonyler . Angrepp på kolatomen i multipelbindningen observeras nästan alltid. I det senare fallet är attacken reversibel; alkoxiradikaler kan emellertid fångas med användning av ett stannanfångande medel.
Stereoselektivitet
Diastereoselektiviteten för radikala cykliseringar är ofta hög . I de flesta fall av helt kol kan selektiviteten rationaliseras enligt Beckwiths riktlinjer, som åberopar det reaktantliknande exo- övergångstillståndet som visas ovan. Att placera substituenter i pseudoekvatorialpositioner i övergångstillståndet leder till cis- produkter från enkla sekundära radikaler. Införande av polära substituenter kan gynna transprodukter på grund av sterisk eller elektronisk repulsion mellan de polära grupperna. I mer komplexa system kräver utvecklingen av övergångstillståndsmodeller hänsyn till faktorer som allylisk töjning och båtliknande övergångstillstånd
(4)
Kirala hjälpmedel har använts i enantioselektiva radikalcykliseringar med begränsad framgång. Små energiskillnader mellan tidiga övergångstillstånd utgör en djupgående barriär för framgång på denna arena. I det visade exemplet är diastereoselektiviteten (för båda konfigurationerna av vänster stereocenter) låg och enantioselektiviteten endast måttlig.
(5)
Substrat med stereocenter mellan den radikala och multipelbindningen är ofta mycket stereoselektiva. Radikala cykliseringar för att bilda polycykliska produkter drar ofta fördel av denna egenskap.
Omfattning och begränsningar
Radikala generationsmetoder
Användningen av metallhydrider ( tenn- , kisel- och kvicksilverhydrider ) är vanligt vid radikala cykliseringsreaktioner; den primära begränsningen av denna metod är möjligheten att reducera den initialt bildade radikalen av HM. Fragmenteringsmetoder undviker detta problem genom att införliva kedjeöverföringsreagenset i själva substratet - den aktiva kedjebärande radikalen frisätts inte förrän efter cyklisering har ägt rum. Produkterna från fragmenteringsmetoder behåller en dubbelbindning som ett resultat, och extra syntetiska steg krävs vanligtvis för att införliva den kedjebärande gruppen.
Atomöverföringsmetoder förlitar sig på förflyttning av en atom från det acykliska utgångsmaterialet till den cykliska radikalen för att generera produkten. Dessa metoder använder katalytiska mängder av svaga reagens, vilket förhindrar problem i samband med närvaron av starka reduktionsmedel (såsom tennhydrid). Väte- och halogenöverföringsprocesser är kända; de senare tenderar att vara mer syntetiskt användbara.
(6)
Oxidativa och reduktiva cykliseringsmetoder finns också. Dessa procedurer kräver ganska elektrofila respektive nukleofila radikaler för att fortskrida effektivt. Cykliska radikaler antingen oxideras eller reduceras och släcks med antingen externa eller interna nukleofiler respektive elektrofiler.
Ringstorlekar
I allmänhet är radikal cyklisering för att producera små ringar svårt. Det är dock möjligt att fånga den cykliserade radikalen innan den öppnas igen. Denna process kan underlättas genom fragmentering (se det treledade fallet nedan) eller genom stabilisering av den cykliserade radikalen (se det fyraledade fallet). Fem- och sexledade ringar är de vanligaste storlekarna som produceras av radikal cyklisering.
(7)
Polycykler och makrocykler kan också bildas med användning av radikalcykliseringsreaktioner. I det förra fallet kan ringar vara förformade och en enda ring sluten med radikal cyklisering, eller flera ringar kan formas i en tandemprocess (enligt nedan). Makrocykliseringar, som saknar FMO-kravet för cykliseringar av mindre substrat, har den unika egenskapen att uppvisa endoselektivitet .
(8)
Jämförelse med andra metoder
I jämförelse med katjoniska cykliseringar undviker radikala cykliseringar problem associerade med Wagner-Meerwein-omläggningar , kräver inte starkt sura förhållanden och kan kontrolleras kinetiskt. Katjoniska cykliseringar är vanligtvis termodynamiskt styrda. Radikala cykliseringar är mycket snabbare än analoga anjoniska cykliseringar och undviker β-elimineringsbireaktioner. Anjonisk av Michael -typ är ett alternativ till radikal cyklisering av aktiverade olefiner. Metallkatalyserade cykliseringsreaktioner kräver vanligtvis milt basiska betingelser, och substrat måste väljas för att undvika eliminering av p-hydrid. Den primära begränsningen av radikala cykliseringar med avseende på dessa andra metoder är potentialen för radikala sidoreaktioner.
Experimentella förhållanden och procedur
Typiska förhållanden
Radikalreaktioner måste utföras under inert atmosfär eftersom dioxygen är en triplettradikal som kommer att fånga upp radikalintermediärer. Eftersom de relativa hastigheterna för ett antal processer är viktiga för reaktionen, måste koncentrationerna noggrant justeras för att optimera reaktionsbetingelserna. Reaktioner utförs i allmänhet i lösningsmedel vars bindningar har höga bindningsdissociationsenergier (BDE), inklusive bensen, metanol eller bensotrifluorid. Även vattenhaltiga förhållanden tolereras, eftersom vatten har en stark OH-bindning med en BDE på 494 kJ/mol. Detta i motsats till många polära processer, där hydroxyliska lösningsmedel (eller polära XH-bindningar i själva substratet) kanske inte tolereras på grund av den funktionella gruppens nukleofilicitet eller surhet.
Exempel förfarande
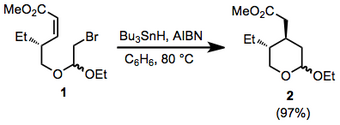
(9)
En blandning av bromacetal 1 (549 mg, 1,78 mmol), AIBN (30,3 mg, 0,185 mmol) och Bu3SnH ( 0,65 ml, 2,42 mmol) i torr bensen (12 ml) upphettades under återflöde i 1 timme och därefter indunstades under reducerat tryck. Silikagelkolonnkromatografi av råprodukten med hexan – EtOAc (92:8) som elueringsmedel gav tetrahydropyran 2 (395 mg, 97%) som en oljig blandning av två diastereomerer. (c 0,43, CHCI3 ) ; IR ( CHCI3 4,77-4,89 ):1732 cm-1; IH NMR (CDCI3 ) 5 (m, 0,6H), 4,66-4,69 (m, 0,4H), 3,40-4,44 (m, 4H), 3,68 (s 3H), 2,61 (dd, J = 15,2, 4,2 Hz, IH), 2,51 (dd, J = 15,2, 3,8 Hz, IH), 0,73-1,06 (m, 3H); masspektrum : m/z 215 (M+-Me); Anal. Beräknat för C12H22O4 : C , 62,6 ; H, 9,65. Funnet: C, 62,6; H, 9,7.