Orto effekt
Ortoeffekt hänvisar huvudsakligen till uppsättningen steriska effekter och vissa bindningsinteraktioner tillsammans med polära effekter orsakade av de olika substituenterna som finns i en given molekyl, vilket resulterar i förändringar i dess kemiska och fysikaliska egenskaper. I en allmän mening är ortoeffekten associerad med substituerade bensenföreningar.
Det finns tre huvudsakliga ortoeffekter i substituerade bensenföreningar: [ förtydligande behövs ]
- Ortoeffekt i substituerad bensoesyra (första ortoeffekt) : Orto-substituerade bensoesyror är starkare syror än deras meta- och paraisomerer, oavsett substituentens natur
- Ortoeffekt i substituerad anilin (andra ortoeffekt/SIP-effekt) : Orto-substituerade aniliner är svagare baser än deras meta- och paraisomerer, oavsett substituentens natur
- Ortoeffekt vid elektrofil aromatisk substitution av disubstituerade bensenföreningar (tredje ortoeffekt) : Den hänvisar till uppsättningen steriska effekter som bestämmer regioselektiviteten för en inkommande elektrofil i disubstituerade bensenföreningar där en metariktande grupp är meta till en orto-para- regigrupp.
Första ortoeffekten i substituerade bensoesyror
När någon grupp är närvarande vid orto till karboxylgrupp i substituerad bensoesyra blir den sura karaktären hos den föreningen åtminstone mer än bensoesyra. I allmänhet är orto-substituerade bensoesyror starkare syror än deras meta- och paraisomerer också. Tabellen nedan visar pKa-värden för olika monosubstituerade bensoesyror.
- Ortoeffekten är stor för nitrobensoesyrorna, som visar nästan en 20-faldig ökning i surhet, ungefär en 8-faldig faktor för halobensoesyrorna och en 2,5- till 3-faldig ökning för metyl- och cyanosubstituenter.
- Metoxibensoesyrorna är exceptionella, eftersom orto- och metaisomererna har nästan identiska pKa: n (ca 4,1), förmodligen på grund av den exceptionella p-π-elektrondonationen från syre.
Allmän förklaring till första ortoeffekt
När en grupp är närvarande orto till karboxylsyragrupp i substituerad bensoesyra, tvingar det steriska hindret karboxylgruppen att vrida sig ut ur bensenringens plan. Detta hämmar resonansen av karboxylgruppen med fenylringen vilket ökar surheten hos karboxylgruppen som annars reducerades på grund av destabiliserande korskonjugering. I själva verket anses denna destabiliserande korskonjugation också vara orsaken till minskad surhet av bensoesyra jämfört med myrsyra.
Även närvaron av en vätebindningsdonator nära en karboxylgrupp kan verka för att öka dess surhet, vilket visas av de tre isomera hydroxibensoesyrorna (se tabellen ovan). Intramolekylär vätebindning av en orto-OH-donator till karbonylsyren i karboxylgruppen, som fungerar som en acceptor, ökar den positiva laddningen på karbonylkolet och följaktligen surheten hos karboxyl-OH.
pKa-värden
| Substitut | Placera på ringen | ||
|---|---|---|---|
| Orto | Meta | Para | |
| H | 4.2 | 4.2 | 4.2 |
| CH 3 | 3.9 | 4.3 | 4.4 |
| F | 3.3 | 4.3 | 4.4 |
| Cl | 2.9 | 3.8 | 4.0 |
| Br | 2.8 | 3.8 | 4.0 |
| jag | 2.9 | 3.9 | 4.0 |
| OMe | 4.1 | 4.1 | 4.5 |
| NO 2 | 2.2 | 3.5 | 3.4 |
| ÅH | 2,98 | 4.08 | 4,58 |
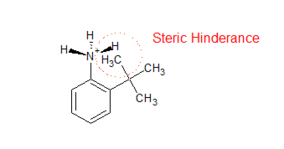
Andra ortoeffekt: ortoeffekt i substituerad anilin (sterisk hämning av protonering).
När någon grupp är närvarande i orto till NH2 i anilin blir den grundläggande karaktären hos den föreningen åtminstone mindre än anilin. Se till exempel grundordningen för följande substituerade anilin:-
- p-toluidin > m-toluidin > anilin > o-toluidin
- Anilin > m-Nitroanilin > p-Nitroanilin > o-Nitroanilin
- Anilin > p-haloanilin > m-haloanilin > o-haloanilin
- p-aminofenol pKb=8,50 > o-aminofenol pKb=9,28 > anilin pKb=9,38 > m-aminofenol pKb=9,80
Allmän förklaring till andra ortoeffekt
- Protonationen av substituerad anilin hämmas på grund av steriskt hinder. Vid protonering ändras hybridiseringen av kväve i aminogruppen från sp 2 till sp 3 vilket gör gruppen icke-plan. Detta orsakar det steriska hindret mellan den ortosubstituerade gruppen och H-atomen i aminogruppen, vilket gör den konjugerade syran mindre stabil, vilket minskar basiciteten hos substituerad anilin (se figuren till höger).
Tredje ortoeffekt: ortoeffekt vid elektrofil aromatisk substitution av disubstituerade bensenföreningar
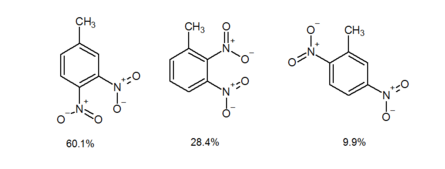
När en meta-dirigerande grupp är meta till en orto-para-dirigerande grupp, går den inkommande gruppen i första hand orto till den meta-dirigerande gruppen snarare än para. Detta kallas ortoeffekten. Det finns ännu ingen bra förklaring till ortoeffekten, även om det möjligen finns intramolekylär assistans från den meta-dirigerande gruppen. Till exempel ger den elektrofila aromatiska nitreringen av 1-metyl-3-nitrobensen 4-metyl-1,2-dinitrobensen och 1-metyl-2,3-dinitrobensen i 60,1 % respektive 28,4 % utbyte. Däremot isoleras 2-metyl-1,4-dinitrobensen (2c) i endast 9,9 % utbyte. Som bevittnas i exemplet ovan, när en π-acceptorsubstituent (πAS) är meta till en π-donatorsubstituent (πDS), sker den elektrofila aromatiska nitreringen orto till πAS snarare än para.
Liknande resultat observerades också på nitrering av 3-metylbensoesyra i vilken 5-metyl-2-nitrobensoesyra och 3-metyl-2-nitrobensoesyra erhölls som huvudföreningar, medan 3-metyl-4-nitrobensoesyra rapporterades som en mindre förening. Även vid nitrering av nitreringen av 3-brombensoesyra erhölls 5-bromo-2-nitrobensoesyra (83 % utbyte) som huvudprodukt och 3-bromo-2-nitrobensoesyra (13 % utbyte) som mindre. På en intressant notering upptäcktes inte den potentiella isomeren 3-bromo-4-nitrobensoesyra.
Ortoeffekt i Diels-Alder-reaktioner
Vid normal elektronefterfrågan Diels-Alder-reaktioner reagerar de Z-substituerade dienofilerna med 1-substituerade butadiener för att ge 3,4-disubstituerade cyklohexener, oberoende av diensubstituenternas natur. Detta är också känt som ortoeffekt.
Anteckningar
externa länkar
- Kompletterande ämnen § Ortoeffekten – Institutionen för kemi, Michigan State University