Ketoacylsyntas
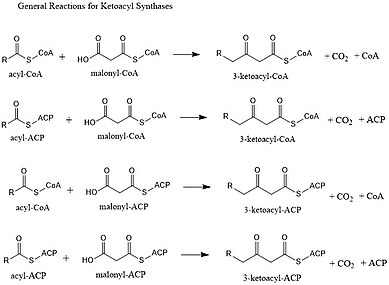
Ketoacylsyntaser (KS) katalyserar kondensationsreaktionen av acyl-CoA eller acyl-acyl ACP med malonyl-CoA för att bilda 3-ketoacyl-CoA eller med malonyl-ACP för att bilda 3-ketoacyl-ACP. Denna reaktion är ett nyckelsteg i fettsyrasyntescykeln, eftersom den resulterande acylkedjan är två kolatomer längre än tidigare. KS existerar som individuella enzymer, som de gör i typ II-fettsyrasyntes och typ II polyketidsyntes, eller som domäner i stora multidomänenzymer, såsom typ I-fettsyrasyntaser (FAS) och polyketidsyntaser (PKS). KS är indelade i fem familjer: KS1, KS2, KS3, KS4 och KS5.
Multidomän enzymsystem
Fettsyrasyntas
Fettsyrasyntas (FAS) är det enzymsystem som är involverat i de novo fettsyrasyntesen. FAS är ett iterativt multienzym som består av flera komponentenzymer, varav ett är ketoacylsyntas. Det finns två typer av FAS: typ I och typ II. Typ I FAS är högintegrerade multidomänenzymer. De innehåller diskreta funktionella domäner som är ansvariga för specifika katalytiska aktiviteter hos reaktionssekvensen, antingen på en enda polypeptidkedja eller på två olika multifunktionella proteiner. Typ II FAS är dissocierade system, vilket betyder att komponentenzymerna är oberoende proteiner som kodas av en serie separata gener.
Polyketidsyntas
Polyketidsyntaser (PKS) är strukturellt och funktionellt relaterade till FAS, som båda är enzymer som katalyserar kondensationen av aktiverade primära metaboliter som acetyl-CoA och malonyl-CoA.
Huvudreaktionen de katalyserar är:
- CO2 - CH2 -CO-S-CoA + CH3 - CO -S-PKS → CH3 - CO-CH2 - CO-S-PKS + CoA-H + CO2
Liksom FAS kommer PKS att använda ett β-ketoacylsyntas (KS), ett valfritt (malonyl) acyltransferas (MAT/AT) och ett fosfonantetienylerat acylbärarprotein (ACP) eller koenzymA (CoA). De använde också båda ett ketoreduktas, dehydratas och enoylreduktas för att skapa en helt mättad acylryggrad. Till skillnad från FAS använder dock PKS vanligtvis ett större antal biosyntetiska byggstenar och bildar ett mer varierat antal svanslängder. De reduktiva stegen som FAS använder är också valfria för PKS. Genom att potentiellt utelämna dem finns det potential för ett mer komplext mönster av funktionalisering.
Det finns tre huvudtyper av polyketider: typ I, typ II och typ III. Typ I är mycket lik FAS typ I, genom att den innehåller linjärt inriktade och kovalent sammansmälta katalytiska domäner inom stora multifunktionella enzymer. Typ II tenderar att vara ett mer dissocierbart komplex med monofunktionella enzymdomäner. Ett annat sätt som PKS:er skiljer sig på är att de har en annan typ, typ III. Typ III PKS är multifunktionella när man väljer en startenhet, monterar kedjan och främjar vikningen.
Ketoacylsyntasfamilj 1
Nästan alla KS1-medlemmar produceras av bakterier, med några bildade av eukaryota och endast en av en arkeon. Det finns 12 underfamiljer. Det dominerande enzymet i KS1-familjen är 3-ketoacyl-ACP-syntas III (KAS III), även känt som 3-oxoacyl-ACP-syntas III och β-ketoacyl-ACP-syntas III, och definieras som EC 2.3.1.180.
p-ketoacyl-ACP-syntas III
Den karakteristiska reaktionen för β-ketoacyl-ACP-syntas III är malonyl-ACP + acetyl-CoA => acetoacyl-ACP + CO 2 + CoA. Cystein, histidin och asparagin bildar den katalytiska triaden i KAS III, som använder den kinetiska mekanismen för pingis.
I Escherichia coli , en organism KAS III finns typiskt i, KASIII är svagt hämmad av tiolaktomycin. I samma organism kommer KAS III att ha ett optimalt pH på 7 och en optimal temperatur på 30-37 °C. Varje organisms inhibitorer, optimala pH och optimala temperaturer kommer att variera något. Dessa siffror är dock ganska indikativa för enzymets ideala miljö i allmänhet.
Ketoacylsyntasfamilj 2
Alla KS2-enzymer produceras av eukaryota, med nästan alla från växter. De vanligaste enzymerna i denna familj är 3-ketoacyl-CoA-syntaser, fettsyraelongaser och mycket långkedjiga fettsyrakondenserande enzymer. Den vanligaste allmänna karakteriseringen för dessa enzymer är EC 2.3.1.-; vissa definieras dock som 2.3.1.119. De flesta enzymer i KS2-familjen katalyserar reaktioner för att producera mycket långkedjiga fettsyror. KS2 kan delas in i 10 underfamiljer.
3-ketoacyl-CoA-syntas I
3-Ketoacyl-CoA-syntas I i Arabidopsis thaliana är involverad i mycket långkedjig fettsyrasyntes, vilket spelar en roll i vaxbiosyntesen. Enzymet katalyserar följande reaktion:
mycket långkedjig acyl-CoA + malonyl-CoA ⇒ mycket långkedjig 3-oxoacyl-CoA + CoA + CO 2
Det är ett elongas som verkar vara involverat i produktionen av mycket långkedjiga fettsyror som är 26 kolatomer och längre. Mefluidid och perfluidon är selektiva hämmare av detta enzym.
Ketoacylsyntasfamilj 3
KS3-familjen är den största familjen i KS-systemet, med 14 underfamiljer. KS3-enzymer produceras främst i bakterier, med ett litet antal eukaryoter och arkéer. KS i denna familj innehåller KS-domäner som finns i både typ I FAS och den modulära typ I av PKS. Även om det finns många lite olika enzymer i denna familj, är de två vanligaste 3-ketoacyl-ACP-syntas I och syntas II.
3-ketoacyl-ACP-syntas I
3-ketoacyl-ACP-syntas I ( EC 2.3.1.41 ) är involverad i processen för kedjeförlängning i typ II FAS. En konsekvens av att inte ha detta enzym blir ett underskott på omättade fettsyror. Den använder fettacyl-tioestrar av ACP och CoA som substrat och har en specificitet nära den för beta-ketoacyl-ACP-syntas II.
Vanligtvis används detta enzym i kondensationsreaktioner, såväl som dekarboxylering och acylgruppöverföring.
Reaktionen fortskrider så här:
- acyl-[acyl-bärarprotein] + ett malonyl-[acyl-bärarprotein] → ett 3-oxoacyl-[acyl-bärarprotein] + CO2 + ett [acyl-bärarprotein]
I Escherichia coli , till exempel, används detta enzym för att konstruera fettacylkedjor genom en Claisen-kondensationsreaktion i tre steg. Reaktionen börjar med en trans-tioesterifiering av acylprimersubstratet. Donatorsubstratet dekarboxyleras sedan, vilket bildar en karbanjonintermediat, som kommer att attackera C1 i primersubstratet och skapa den förlängda acylkedjan.
Det finns ett antal molekyler kända för att vara inhibitorer av syntas I. Till exempel, i vissa fall, hämmar acyl-CoA i sig själva enzymet vid höga koncentrationer i Escherichia coli. Cerulenin är känt för att hämma syntas I i Carthamus tinctorius , Spinacia oleracea , Brassica napus , Allium ampeloprasu , Streptococcus pneumoniae , Escherichia coli , Mycobacterium tuberculosis och många fler. I Mycobacterium tuberculosis är palmitoyl-CoA en hämmare, och tiolaktomycin finns också i ett antal organismer.
Det optimala pH-intervallet varierar mycket från organism till organism, men tenderar totalt sett att ligga mellan 5,5-8,5. Optimal temperatur är densamma, med 20 °C i ena änden av spektrumet, men 37 °C i den andra.
3-ketoacyl-ACP-syntas II
3-Ketoacyl-ACP-syntas II är involverat i typ II FAS som förekommer i växter och bakterier. Även om mycket liknar beta-ketoacyl-ACP-syntas I, finns det en liten skillnad mellan de två. En huvudskillnad är att syntas II lätt kan använda palmitoleoyl-ACP som substrat, medan syntas I inte kan. Detta möjliggör kontroll av den temperaturberoende regleringen av fettsyrasammansättningen.
Reaktionen fortskrider så här:
- ( Z )-hexadek-11-enoyl-[acyl-bärarprotein] + malonyl-[acyl-bärarprotein] → ( Z )-3-oxooktadec-13-enoyl-[acyl-bärarprotein] + CO 2 + [acyl -bärarprotein
I Streptococcus pneumoniae , till exempel, används syntas II som ett förlängningskondenserande enzym. Den innehåller en katalytisk triad av Cys134, His337 och His303, såväl som Phe396 och en vattenmolekyl bunden till det aktiva stället. Det nukleofila cysteinet krävs för acylenzymbildning och används i den övergripande kondensationsaktiviteten. His 337 används också för kondensationsaktiviteten, speciellt stabiliseringen av den negativa laddningen på malonyltioesterkarbonyl i övergångstillståndet. His303 används för att påskynda katalys genom att deprotonera vattenmolekylen för att möjliggöra en nukleofil attack på malonat och därigenom frigöra bikarbonat. Phe396 fungerar som en gatekeeper som kontrollerar ordningen för tillägg av substrat.
Det finns ett antal molekyler kända för att hämma detta enzym. Till exempel hämmar cerulenin syntas II i Spinacia oleracea , Allium ampelprasum , Escherichia coli och Streptococcus pneumonia . I Escherichia coli är platensimycin, tiolaktomycin och jodacetamid också kända inhibitorer.
Optimalt pH-intervall kommer att variera beroende på organismen. Hos Escherichia coli är intervallet 5,5–6,1. Hos Streptococcus pneumoniae , 6,8–7, hos Plasmodium falciparum 7,5, och hos Spinacia oleracea , 8,1–8,5. Optimal temperatur kommer att variera, men förblir för det mesta i intervallet 30–37 °C.
Ketoacylsyntas familj 4
En majoritet av KS4-enzymer finns i eukaryota organismer, medan resten är från bakterier. Dessa enzymer klassificeras normalt som antingen chalkonsyntaser, stilbensyntaser eller typ III PKS. Sammantaget finns det 10 olika underfamiljer inom KS4. Vanligtvis kommer KS4-medlemmar att ha en Cys-His-Asn-katalytisk triad. Både chalkonsyntaser och stilbensyntaser kommer att katalysera samma acylöverförings-, dekarboxylerings- och kondensationssteg som i KS1. Men de kommer också att cyklisera och aromatisera reaktionerna ytterligare innan den slutliga chalkonprodukten bildas.
Chalcone syntas
Kalkonsyntas ( EC 2.3.1.74 ), även känd som naringenin-kalkonsyntas, är ansvarig för reaktionen:
- 3 malonyl-CoA + 4-kumaroyl-CoA → 4 CoA + naringeninkalkon + 3 CO 2
I Medicago sativa , till exempel, sker reaktionen under loppet av ett laddningssteg, ett dekarboxyleringssteg och slutligen ett töjningssteg.
Ett antal inhibitorer inkluderar cerulenin i Sinapis alba, Daucus carota och Phaseolus vulgaris , apigenin i Secale cereale och Avena sativa och eriodictyol i Decale cereal, Daucus carota och Xanthisma gracile.
Det optimala pH vid vilket detta enzym kan fungera varierar mellan organismer, men är vanligtvis placerat någonstans mellan 6 och 8. Detsamma gäller för optimal temperatur vid 30-45 °C.
Ketoacylsyntas familj 5
KS5 familjemedlemmar är alla närvarande i eukaryota celler, mestadels djur. De flesta av dessa enzymer kan klassificeras som fettsyraelongaser. Dessa enzymer är kända för att användas vid förlängning av mycket långkedjiga fettsyror. KS5 har 11 underfamiljer. Lite är ännu känt om KS5-familjen. För närvarande har inget av de specifika enzymerna EG-nummer. Inga katalytiska triadrester har bekräftats. Konserverade histidin- och asparaginrester har hittats, med histidinet i en membranomspännande region. Emellertid är det ännu inte kända konserverade cysteinrester.