Intermolekylära metallkatalyserade karbenoidcyklopropaneringar
Metallkatalyserade intermolekylära karbenoidcyklopropanationer är organiska reaktioner som resulterar i bildandet av en cyklopropanring från en metallkarbenoidart och en alken . I Simmons-Smith-reaktionen är den involverade metallen zink.
Introduktion
Cyklopropaner kan bildas genom reaktionen av en metallkarbenoidart (genererad genom reaktionen av en diazoförening med en övergångsmetall) och en olefin. Även om den intramolekylära varianten av denna reaktion har varit känd sedan 1961, är kemo- och stereoselektiva intermolekylära metallkatalyserade cyklopropaneringsreaktioner som använder diazokarbonylföreningar nyare. Rodiumkarboxylatkomplex, såsom dirhodiumtetraacetat, används oftast för att katalysera denna transformation. Enantioselektiva cyklopropanationer har utvecklats och använder sig vanligtvis av förbildade kirala rodiumkarboxylatkomplex härledda från kirala karboxylatligander.
(1)
Mekanism och stereokemi
Rådande mekanism
Definitiva mekanistiska studier av rodiumkatalyserad cyklopropanering saknas. Mekanismen har dock rationaliserats baserat på produktdistribution och stereoselektivitet. Angrepp av diazoföreningen på metallcentrumet genererar ett zwitterjoniskt metallalkylkomplex, som driver ut kvävgas för att ge en metallkarbenmellanprodukt. Samordnad tillsats av metallkarbenen till olefinen (utan direkt koordinering av olefinen till metallen) genererar den observerade cyklopropanprodukten. Konfigurationen av olefinen bibehålls under hela processen; emellertid kan metallkarbener med heterotopiska ytor generera en blandning av diastereomerer, som visas till höger om ekv. (2).
(2)
Produktens konfiguration bestäms av olefinens närmande till metallkarbenen. I reaktioner av monosubstituerade metallkarbener med terminala olefiner närmar sig olefinen sannolikt "end-on" (med kol-kol-dubbelbindningen av olefinen nästan parallell med metall-kol-dubbelbindningen i karbenen) med olefin R-gruppen pekad bort från substituenten av karbenen. En andra övergångstillståndsmodell har föreslagits för reaktioner av vinylsubstituerade karbener. I denna modell närmar sig olefinen "side-on" (med kol-kol-dubbelbindningen av olefinen vinkelrät mot metall-kol-dubbelbindningen av karbenen) med olefinen R-gruppen långt från vinylgruppen.
Stereoselektiva varianter
Metoder för stereoselektiv syntes av cyklopropaner från diazokarbonylföreningar och olefiner har förlitat sig på antingen användningen av förformade kirala rodiumkatalysatorer eller kirala hjälpämnen på diazokarbonylföreningen. Till exempel är Rh2 [ S - DOSP] 4 en mycket effektiv katalysator för enantioselektiv cyklopropanering av alkener.
(3)
Kirala hjälpämnen härledda från lättillgängliga kirala alkoholer (såsom pantolakton) kan användas för diastereoselektiva cyklopropaneringar med diazoestrar.
(4)
Omfattning och begränsningar
Cyklopropanering av olefiner med diazokarbonylföreningar åstadkoms oftast med användning av rodiumkarboxylatkomplex, även om koppar ursprungligen användes. Omfattningen av olefinen är i allmänhet ganska bred - elektronrika, neutrala och elektronfattiga olefiner har alla cyklopropanerats effektivt med användning av rodiumbaserade katalysatorsystem. Detta avsnitt beskriver de olika klasserna av diazokarbonylföreningar som reagerar med olefiner under rodiumkatalys för att ge cyklopropaner.
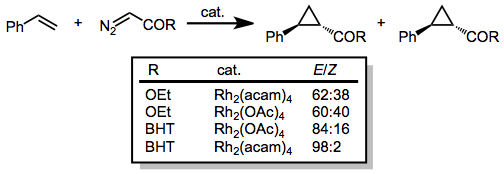
Diazoacetater som har en enda karbonylsubstituent bunden till diazokolet har använts för cyklopropanering av ett brett spektrum av olefiner. Diastereoselektiviteten för ( E )-cyklopropanen ökar när storleken på estergruppen ökar. Tillsats av elektrondensitet till katalysatorn (till exempel genom att ersätta acetatligander med acetamid, acam) ökar dessutom reaktionens diastereoselektivitet.
(5)
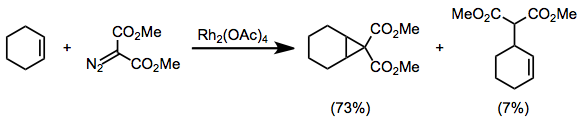
Diazokarbonylföreningar substituerade med två elektronbortdragande grupper, såsom diazomalonater, är benägna att uppleva sidoreaktioner under cyklopropaneringsbetingelser. [3+2] Cyclloaddition och CH-insättningsbiprodukter har observerats.
(6)
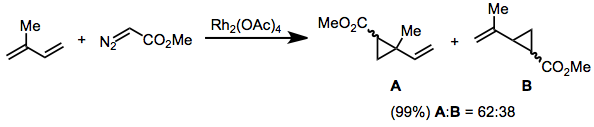
Diazoacetater substituerade med en vinyl- eller arylgrupp på diazokolet är icke-reaktiva mot trans -alkener. Detta resultat har förklarats genom att åberopa övergångstillståndsmodellen i Ekv. (2). Reaktioner av dessa substrat är mycket selektiva för ( E )-cyklopropanisomeren.
(7)
Vinyldiazoacetater reagerar med diener för att ge divinylcyklopropaner, som genomgår Cope-omlagring för att ge cykloheptadiener. Den mer substituerade dubbelbindningen av dien reagerar företrädesvis.
(8)
(9)
Furaner reagerar på liknande sätt med vinyldiazoacetater, även om mellanprodukten cyklopropan kan omvandlas antingen till Cope-omlagringsprodukten eller en öppnad omättad karbonylförening. Distributionen av dessa produkter är starkt beroende av furanens substitutionsmönster.
(10)
Pyrroler reagerar med vinyldiazoacetater för att bilda kvävebryggade cykloheptadiener. Användningen av metyllaktat som ett kiralt hjälpmedel på vinyldiazoacetatet ledde till måttlig diastereoselektivitet vid tandemcyklopropanering/Cope-omlagring av Boc-skyddad pyrrol.
(11)
Syntetiska applikationer
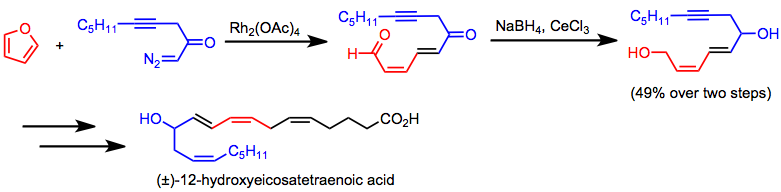
Enantioselektiv intermolekylär cyklopropanering har använts för syntes av kirala cyklopropanantibiotika, såsom cilastatin. (12) Tandemcyklopropanering/fragmentering är ett nyckelsteg i syntesen av 12-hydroxieikosatetraensyra.
(12)
Jämförelse med andra metoder
Simmons-Smith cyklopropanering, som använder karbener som härrör från dietylzink och dijodmetan, är ett populärt alternativ till rodiumkatalyserad cyklopropanering. I närvaro av en kiral diamin är Simmons-Smith-cyklopropanering enantioselektiv; selektiviteterna är emellertid inte lika höga som motsvarande rodiumkatalyserade reaktioner.
(13)
Substituerade zinkkarbenoider kan framställas från motsvarande ketoner eller aldehyder genom en sekvens som är analog med mekanismen för Clemmensen-reduktionen . Cyklopropanering av olefiner med dessa mellanprodukter sker med måttlig diastereoselektivitet och utbyte.
(14)
Andra diazoföreningar förutom diazokarbonylföreningar har använts för rodiumkatalyserade cyklopropaneringar; emellertid är dessa substrat mycket svårare att hantera och instabila än diazokarbonylföreningar. Således har de inte använts i stor utsträckning för organisk syntes.
(15)
Experimentella villkor och tillvägagångssätt
Typiska förhållanden
Stor försiktighet bör iakttas vid hantering av diazoföreningar, som är giftiga och potentiellt explosiva. Reaktioner bör utföras i ett välventilerat dragskåp bakom en sprängsköld.
Rodium(II)karboxylatkomplex framställs lätt och obestämt stabila i luft. Karbendimerisering är ett betydande problem i dessa reaktioner, men kan övervinnas genom långsam tillsats av diazoföreningen eller användning av ett stort överskott av alken. Reaktionen utförs vanligtvis under inert atmosfär under vattenfria betingelser, och det vanligaste lösningsmedlet som används är diklormetan. Emellertid kan enantioselektiviteten hos asymmetriska cyklopropaneringar vara starkt beroende av lösningsmedlet.
Exempel tillvägagångssätt
(16)
En blandning av styren (44,2 g, 424 mmol) och Rh2 ( S - DOSP) 4 (1,58 g, 0,85 mmol) i pentan (350 ml) omrördes vid -78° under en argonatmosfär. Till denna lösning sattes metyl ( E )-2-diazo-4-fenyl-3-butenoat (17,2 g, 84,8 mmol) i pentan (0,12 M) under 30 minuter, och reaktionsblandningen omrördes sedan vid -78° under 24 timmar. Blandningen koncentrerades sedan i vakuum och återstoden renades på kiseldioxid med användning av eter/petroleumeter (0:100 till 10:90) som elueringsmedel för att ge (1S, 2S ) -metyl -2p-fenyl-lp-[ 2-( Z )-styryl]cyklopropan-la-karboxylat (16,05 g, 68%) som ett vitt fast ämne (smp 57-60°; 98% ee); IR (CHCI3 ) 3110, 3090, 3060, 2980, 2950, 2880, 1735 cm-1; ^ H NMR (148) (CDCI3 ) 1,85 (dd, J = 7,3, 5,1 Hz, IH), 2,05 (dd, J = 9,1, 5,1 Hz, IH), 3,04 (dd, J = 9,1, 7,3 Hz 1H), 3,77 (s, 3 H), 6,15 (d, J = 15,9, 1 H), 6,37, (d, J = 15,9 Hz, IH), 7,12-7,28 (m, 10 H); 13C NMR (CDCI3 ) 18,5, 33,2, 34,9, 52,3, 124,0, 126,1, 126,7, 127,2, 127,9, 128,3, 129,0, 133,0, 137,0, 134,0, 135,0, 137,0; [a]25D – 166° (c 1,1, CHCI3 ) ; Anal. Beräkn. för C19H18O2 : C , 81,99 ; H, 6,52. Funnet: C, 81,74; H, 6,53.