In vivo magnetisk resonansspektroskopi
In vivo magnetisk resonansspektroskopi ( MRS ) är en specialiserad teknik förknippad med magnetisk resonanstomografi (MRT) .
Magnetisk resonansspektroskopi (MRS), även känd som kärnmagnetisk resonans (NMR) spektroskopi, är en icke-invasiv, joniserande strålningsfri analysteknik som har använts för att studera metabola förändringar i hjärntumörer , stroke , anfallsstörningar , Alzheimers sjukdom , depression och andra sjukdomar som påverkar hjärnan. Det har också använts för att studera metabolismen av andra organ som muskler . När det gäller muskler används NMR för att mäta halten av intramyocellulära lipider (IMCL).
Magnetisk resonansspektroskopi är en analysteknik som kan användas för att komplettera den vanligare magnetiska resonanstomografin (MRI) vid karakterisering av vävnad. Båda teknikerna tar vanligtvis signaler från väteprotoner (andra endogena kärnor som de av kol, kväve och fosfor används också), men MRT hämtar signaler främst från protoner som finns i vatten och fett, som är ungefär tusen gånger mer rikligt än molekylerna detekterade med MRS. Som ett resultat använder MRI ofta den större tillgängliga signalen för att producera mycket rena 2D-bilder, medan MRS mycket ofta bara tar emot signaler från en enda lokaliserad region, kallad en "voxel". MRS kan användas för att bestämma de relativa koncentrationerna och fysikaliska egenskaperna hos en mängd olika biokemikalier som ofta kallas "metaboliter" på grund av deras roll i metabolismen .
Datainsamling
Att skaffa en MRS-skanning är mycket lik den för MRT med några ytterligare steg före datainsamlingen. Dessa steg inkluderar:
- Shimming av magnetfältet: detta steg tas för att korrigera för inhomogeniteten hos magnetfältet genom att ställa in olika pulser i x-, y- och z-riktningarna. Detta steg är vanligtvis automatiserat men kan utföras manuellt.
- Undertrycka vattensignalen: eftersom vattenmolekyler innehåller väte och den relativa koncentrationen av vatten till metabolit är cirka 10 000:1, undertrycks ofta vattensignalen eller så kommer metabolittopparna inte att urskiljas i spektra. Detta uppnås genom att lägga till vattendämpningspulser. De senaste framstegen tillåter proton MRS utan vattendämpning.
- Att välja en spektroskopisk teknik: noggrann planering av mätningar är viktigt i samband med ett specifikt experiment.
- Single Voxel Spectroscopy (SVS): har en minsta rumslig upplösning på cirka 1 cm 3 och har det renaste spektrumet fritt från oönskade artefakter på grund av den lilla förvärvade volymen som leder till lätt shim och mindre oönskade signaler från utsidan av voxeln.
- Magnetic Resonance Spectroscopic Imaging (MRSI): en 2-dimensionell (eller 3-dimensionell) MRS-teknik som använder två/tre faskodningsriktningar för att skapa en två/tredimensionell karta av spektra. Nackdelarna med denna teknik är att att ha två/tre-fas kodningsriktningar kräver lång skanningstid, och den större insamlingsvolymen är mer sannolikt att introducera artefakter på grund av sämre shimsning, ej undertryckt vatten, såväl som den inneboende sinc point-spread - funktionen på grund av den ändliga samplingen av k-utrymme som resulterar i att signalen från en voxel blöder in i alla andra.
Datakvantifiering
Under datainsamlingen samlar skanningen in rådata i form av spektra. Dessa rådata måste kvantifieras för att uppnå en meningsfull förståelse av spektrumet. Denna kvantifiering uppnås via linjär kombination. Linjär kombination kräver kunskap om de underliggande spektrala formerna, kallade basuppsättningar. Basuppsättningar förvärvas antingen via numerisk simulering eller experimentellt mäts i fantomer. Det finns många paket tillgängliga för att numeriskt simulera basuppsättningar, inklusive MARSS, FID-A, bland annat som GAMMA, VESPA och spenat. Med basuppsättningarna kan rådata nu kvantifieras som uppmätta koncentrationer av olika kemiska arter. Programvara används för att slutföra detta. LCModel, en kommersiell programvara, har under större delen av fältets historia varit standardpaketet för kvantifiering av programvara. Men nu finns det många gratisprogram för kvantifiering: AMARES, AQSES, Gannet, INSPECTOR, jMRUI, TARQUIN och mer.
Innan linjär kombination användes toppextraktion för datakvantifiering. Detta är dock inte längre populärt eller rekommenderat. Toppextraktion är en teknik som integrerar området under en signal. Trots dess till synes okomplicerade, finns det flera förvirringar med denna teknik. I huvudsak skalar de individuella Lorentziska formerna inte upp för att matcha komplexiteten hos de spektrala formerna av J-kopplade metaboliter och är för enkla för att urskilja mellan överlappande toppar.
Pulssekvenser
I likhet med MRT använder MRS pulssekvenser för att ta emot signaler från flera olika molekyler för att generera ett spektra istället för en bild. I MRS är STEAM (Stimulated Echo Acquisition Method) och PRESS (Point Resolved Spectroscopy) de två primära pulssekvensteknikerna som används. När det gäller fördelar är STEAM bäst för att avbilda metaboliter med kortare T2 och har lägre SAR, medan PRESS har högre SNR än STEAM. STEAM och PRESS används mest på grund av deras implementering på de stora leverantörerna av MR-skannrar. Bortom STEAM och PRES finns det sekvenser som använder adiabatiska pulser. Adiabatiska pulser producerar enhetliga vändningsvinklar även när det finns extrem B 1 inhomogenitet. Således tillåter dessa sekvenser oss att uppnå excitation som uppnår den eftersökta B 1 -okänsligheten och off-resonansen i RF-spolen och det samplade objektet. Närmare bestämt löser adiabatiska pulser problemet med signalbortfall som kommer från de olika B 1 flödesmönstren som är ett resultat av de använda ytsändningsspolarna och användningen av normala pulser. Adiabatiska pulser är också användbara för begränsningar av RF-toppeffekt för excitation och sänkning av vävnadsuppvärmning. Dessutom har adiabatiska pulser avsevärt högre bandbredd, vilket minskar artefakter för kemisk skiftförskjutning, vilket är särskilt viktigt vid höga fältstyrkor och när ett stort frekvensområde är önskvärt att mätas (dvs. mätning av både signalerna upp- och nedfält av vatten i proton FRU).
Rumsliga lokaliseringssekvenser
I PRESS är de två främsta nackdelarna lång ekotid (TE) och artefakter för kemisk skiftförskjutning (CSD). Lång ekotid uppstår av att PRESS använder två 180°-pulser, till skillnad från STEAM som uteslutande använder 90°-pulser. Varaktigheten av 180°-pulser är i allmänhet längre än 90°-pulser eftersom det tar mer energi att vända en nettomagnetiseringsvektor helt i motsats till endast 90°. Kemiska skiftförskjutningsartefakter uppstår delvis på grund av mindre optimala skivvalsprofiler. Flera 180°-pulser tillåter inte en mycket kort TE, vilket resulterar i en mindre optimal skivvalsprofil. Dessutom innebär flera 180°-pulser mindre bandbredd och därmed större kemisk skiftförskjutning. Specifikt uppstår de kemiska skiftförskjutningsartefakterna eftersom signaler med olika kemiska skift upplever olika frekvenskodade skivval och därför inte kommer från samma volym. Dessutom blir denna effekt större vid högre magnetfältstyrkor.
SPECIAL består av en rumsligt selektiv pre-excitationsinversionspuls (typiskt AFP) följt av spatiellt selektiv exciterings- och omfokuseringspulser, som båda vanligtvis är SLR eller trunkerade sinc-pulser.
SPECIAL är en hybrid av PRESS och Image-Selected In Vivo Spectroscopy (ISIS). ISIS uppnår rumslig lokalisering i de tre rumsliga dimensionerna genom en serie av åtta skivselektiva förinversionspulser som kan placeras på lämpligt sätt så att summan av de åtta cyklerna tar bort all signal utanför den önskade 3D-regionen. SPECIAL erhåller rumslig lokalisering från endast en enstaka dimension med inversionspulser före excitation (som slås på och av varannan repetitionstid [TR]), vilket gör det till en tvåcykelsekvens.
Användningen av preinversionspulsen för att ta bort en omfokuseringspuls (jämfört med PRESS) är det som gör att SPECIAL kan uppnå en kort TE, som når minst 2,2 msek på en preklinisk skanner i råtthjärnan samtidigt som den kan återställa hela signalen och som låga som 6 msek på en klinisk 3T-skanner.
Den största nackdelen med SPECIAL och SPECIAL-sLASER är att de är tvåcykelscheman, och systematiska variationer mellan cyklerna kommer att visa sig i deras skillnadsspektrum. Lipidkontamination är ett särskilt stort problem med SPECIAL och liknande sekvenser.
Den senaste lokaliseringssekvensen är sLASER, som använder två par adiabatiska omfokuseringspulser. Detta har nyligen rekommenderats av konsensus.
Den första är genom OVS, som kommer att minska kontamineringen av lipidsignaler som kommer från utanför voxeln, även om detta kommer till priset av en ökning av SAR. Det andra är att inte ställa in amplituden för förexciteringsinversionspulsen till noll varannan TR, utan istället att flytta platsen för detta ISIS-plan så att den exciterade volymen för avstängt tillstånd är utanför objektet. Detta har visat sig avsevärt minska lipidkontamination, som spekuleras ha uppstått från interaktionen mellan RF-pulsen och lipidavdelningarna på grund av ofullständig avslappning, magnetiseringsöverföring eller den homonukleära Overhauser-effekten, även om den exakta mekanismen förblir okänd. Den tredje är att använda en eko-planär avläsning som avfasar magnetisering från utsidan av voxeln, vilket också har visat sig avsevärt reducera lipidartefakter. Alla tre metoderna kunde kombineras för att övervinna lipidkontamination.
En av dimensionerna att förstå om en pulssekvens är dess koherensväg. Koherensvägen är sekvensen av kvantkoherensnummer som signalen tar innan den förvärvas. Alla koherensvägar slutar på -1, eftersom detta är den enda koherensvägen som detekteras av kvadraturspolar. Sekvenserna av spinekotyp (PRESS, sLASER, LASER) växlar helt enkelt mellan +1 och -1. Till exempel är koherensvägen för PRESS (uttryckt som en vektor) [-1, 1, -1]. Detta indikerar att efter den initiala RF-pulsen (excitationspuls) har spinnen en -1 kvantkoherens. Omfokuseringspulserna byter sedan -1 till +1 och sedan tillbaka från +1 till -1 (där det sedan detekteras). På liknande sätt för sLASER är koherensvägen [-1, 1, -1, 1, -1]. Koherensvägen för LASER är [-1, 1, -1, 1, -1, 1, -1]. Koherensvägen för SPECIAL är [0, 1, -1]. Detta indikerar att efter den första RF-pulsen finns signalen som en population, på grund av dess 0 kvantkoherensnummer. Koherensvägar är kritiska eftersom de förklarar hur sekvenserna påverkas av krossar och fascykler. Som sådan har koherensvägsanalys använts för att utveckla optimerade krossscheman och fascykelscheman för ett godtyckligt MRS-experiment.
Används
MRS tillåter läkare och forskare att få biokemisk information om människokroppens vävnader på ett icke-invasivt sätt (utan behov av en biopsi ), medan MRT endast ger dem information om kroppens struktur (fördelningen av vatten och fett) . ).
Till exempel, medan MRT kan användas för att hjälpa till vid diagnos av cancer , kan MRS potentiellt användas för att hjälpa till med information om tumörens aggressivitet. Dessutom, eftersom många patologier verkar lika vid diagnostisk bildbehandling (såsom strålningsinducerad nekros och återkommande tumör efter strålbehandling), kan MRS i framtiden användas för att hjälpa till att skilja mellan liknande prognoser.
MRS-utrustning kan ställas in (precis som en radiomottagare ) för att fånga upp signaler från olika kemiska kärnor i kroppen. De vanligaste kärnorna som ska studeras är protoner ( väte ), fosfor , kol , natrium och fluor .
De typer av biokemikalier ( metaboliter ) som kan studeras inkluderar kolininnehållande föreningar (som används för att göra cellmembran ), kreatin (en kemikalie involverad i energimetabolism ) , inositol och glukos (båda sockerarter ), N-acetylaspartat och alanin och laktat som är förhöjda i vissa tumörer.
För närvarande används MRS främst som ett verktyg av forskare (t.ex. medicinska fysiker och biokemister ) för medicinska forskningsprojekt , men det börjar bli uppenbart att det också har förmågan att ge läkare användbar klinisk information, särskilt med upptäckten att den kan användas att undersöka koncentrationen av alfa-hydroxiglutarsyra , som endast finns i IDH1- och IDH2 -muterade gliom , vilket ändrar den föreskrivna behandlingsregimen.
MRS används för närvarande för att undersöka ett antal sjukdomar i människokroppen , framför allt cancer (i hjärna , bröst och prostata ), epilepsi , Alzheimers sjukdom , Parkinsons sjukdom och Huntingtons chorea . MRS har använts för att diagnostisera hypofystuberkulos.
Prostatacancer : I kombination med en magnetisk resonanstomografi (MRT) och givet lika resultat kan den tredimensionella MRS förutsäga prevalensen av en malign degeneration av prostatavävnad med cirka 90 %. Kombinationen av båda metoderna kan vara till hjälp vid planeringen av biopsier och behandlingar av prostata, såväl som för att övervaka framgången av en terapi.
Exempel
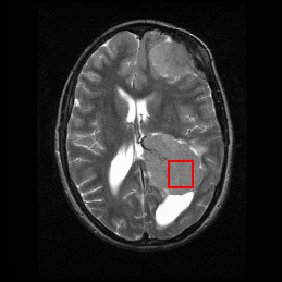
Nedan visas en MR-hjärnskanning (i det axiella planet, det vill säga skärning från fram-till-baksida och sida till sida genom huvudet) som visar en hjärntumör ( meningiom ) längst ner till höger. Den röda rutan visar volymen av intresse från vilken kemisk information erhölls med MRS (en kub med 2 cm sidor som ger en kvadrat när den skär den 5 mm tjocka delen av MRI-skanningen).
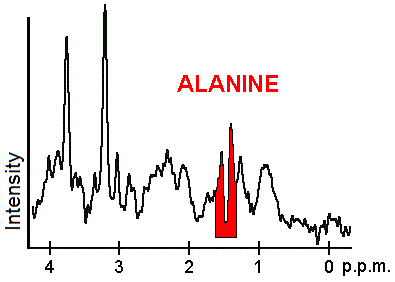
Varje biokemikalie, eller metabolit, har en annan topp i spektrumet som uppträder med en känd frekvens. Topparna som motsvarar aminosyran alanin är markerade i rött (vid 1,4 ppm). Detta är ett exempel på den typ av biokemisk information som kan hjälpa läkare att ställa sin diagnos . Andra viktiga metaboliter är kolin (3,2 ppm) och kreatin (3,0 ppm).
Tillämpningar av MRS
| Metabolit | Stort kemiskt skifte (ppm) | Fungera | in vivo MRS-applikationer | Kliniska applikationer |
|---|---|---|---|---|
| N-acetylaspartat (NAA) | 2.01 |
|
Markör för neuronal täthet Koncentrationsmarkör |
|
| N-acetyl aspartylglutamat (NAAG) | 2.04 |
|
Summan av NAA och NAAG ger en tillförlitlig uppskattning av NAA-innehållande molekyler |
|
| Adenosintrifosfat (ATP) | 4,20 - 4,80, 6,13, 8,22 |
|
Detekteras normalt med 31P NMR-spektroskopi, svårare att detektera med 1H NMR-spektroskopi |
|
| Alanine (Ala) | 1,40 |
|
Ingen |
|
| y-aminosmörsyra (GABA) | 3.00 |
|
Ingen |
|
| Askorbinsyra (Asc - Vitamin C) | 4,49 |
|
Mål för hyperpolariserade 13 C-applikationer för att avbilda redoxstatusen in vivo |
|
| Asparaginsyra (Asc) | 3,89 |
|
Ingen |
|
| Karnitin | 3.21 |
|
Ingen |
|
| Karnosin | 7.09 |
|
Icke-invasiv metod för att mäta intracellulärt pH med ' H NMR in vivo |
|
| Kolininnehållande föreningar (tCho) | 3,20 |
|
Ingen |
|
| Citronsyra | 2,57, 2,72 |
|
Ingen |
|
| Kreatin (Cr) och Fosfokreatin (PCr) | 3.03 |
|
Ingen |
|
| Deoxymyoglobin (DMb) | 79,00 |
|
Ingen |
|
| Glukos (Glc) | 5.22 |
|
Gemensamt mål i 13 C-applikationer för att studera metabola vägar |
|
| Glutamat (Glu) | 2.20 - 2.40 |
|
Separationen mellan glutamat och glutamin blir opålitlig, även om summan (Glx) kan kvantifieras med hög noggrannhet |
|
| Glutamin (Gln) | 2.20 - 2.40 |
|
Separationen mellan glutamat och glutamin blir opålitlig, även om summan (Glx) kan kvantifieras med hög noggrannhet |
|
| Glutation (GSH)> | 3,77 |
|
Ingen |
|
| Glycerol | 3,55, 3,64, 3,77 |
|
Svårt att observera i ' H NMR-spektra på grund av linjebreddning |
|
| Glycin | 3,55 |
|
Ingen |
|
| Glykogen | 3,83 |
|
Rutinmässigt observerad i 13C NMR, men förblir svårfångad i 1H NMR |
|
| Histidin | 7,10, 7,80 |
|
Upprätta intracellulärt pH i ' H NMR |
|
| Homokarnosin | 7.10, 8.10, 3.00 - 4.50 |
|
Bra val för in vivo pH-övervakning På grund av överlappningen mellan GABA- och homokarnosinresonanser är GABA H-4-resonansen vid 3,01 ppm den "totala GABA" som representerar summan av GABA och homokarnosin |
|
| β-hydroxibutyrat (BHB) | 1.19 |
|
Ingen |
|
| 2-hydroxiglutarat (2HG) | 1,90 |
|
Ingen |
|
| myo -Inositol (mI) | 3,52 |
|
Ingen |
|
| scyllo -Inositol (SI) | 3,34 |
|
Ingen |
|
| Laktat (Lac) | 1.31 |
|
Ingen |
|
| Lipider | 0,9 - 1,5 |
|
Högt överflöd av lipider är en av huvudorsakerna till att 1H NMR utanför hjärnan har sett begränsade tillämpningar |
|
| Makromolekyler | 0,93 (MM1), 1,24 (MM2), 1,43 (MM3), 1,72 (MM4), 2,05 (MM5), 2,29 (MM6), 3,00 (MM7), 3,20 (MM8), 3,8 - 4,0 (MM9), 4,3 (MM10) ) |
|
En betydande del av den observerade signalen är makromolekylära resonanser som ligger bakom resten av metaboliterna Korta T2- relaxationstidskonstanter eliminerar effektivt makromolekylära resonanser från 1H NMR-spektra med lång ekotid Skillnaden i T 1 -relaxationer mellan metaboliter och makromolekyler används för att minska bidraget från extrakraniell lipidsignal |
|
| Nikotinamid Adenin Dinukleotid (NAD + ) | 9.00 |
|
31P NMR tillåter detektion av både NAD + och NADH, medan 1H NMR inte tillåter detektion för NADH |
|
| Fenylalanin | 7.30 - 7.45 |
|
Ingen |
|
| Pyruvat | 2,36 |
|
Endast FDA-godkänd förening för hyperpolariserad 13C NMR |
|
| Serine | 3.80 - 4.00 |
|
Ingen |
|
| Taurin (Tau) | 3,25, 3,42 |
|
Ingen |
|
| Threonine (Thr) | 1,32 |
|
Ingen |
|
| Tryptofan (Trp) | 7,20, 7,28 |
|
Ingen |
|
| Tyrosin (Tyr) | 6,89 - 7,19 |
|
Ingen |
|
| Vatten | 4,80 |
|
Intern koncentrationsreferens Vattenkemiskt skift används för att upptäcka temperaturförändringar icke-invasivt in vivo |
|
I 1H magnetisk resonansspektroskopi kan varje proton visualiseras vid ett specifikt kemiskt skift (toppposition längs x-axeln) beroende på dess kemiska miljö. Denna kemiska förändring dikteras av angränsande protoner i molekylen. Därför kan metaboliter karakteriseras av deras unika uppsättning 1H kemiska skift. De metaboliter som MRS sonderar efter har kända ( 1 H) kemiska förändringar som tidigare har identifierats i NMR-spektra. Dessa metaboliter inkluderar:
- N-acetylaspartat (NAA): med sin huvudsakliga resonanstopp vid 2,02 ppm, minskning av nivåerna av NAA indikerar förlust eller skada på neuronal vävnad, vilket är ett resultat av många typer av förolämpningar mot hjärnan. Dess närvaro under normala förhållanden indikerar neuronal och axonal integritet.
- Kolin : med sin huvudsakliga topp vid 3,2 ppm är kolin känd för att vara associerad med membranomsättning eller ökning av celldelning. Ökat kolin indikerar ökning av cellproduktion eller membrannedbrytning, vilket kan tyda på demyelinisering eller närvaro av maligna tumörer.
- Kreatin och fosfokreatin : med sin huvudsakliga topp på 3,0 ppm, markerar kreatin metabolismen av hjärnenergi. Gradvis förlust av kreatin i kombination med andra huvudmetaboliter indikerar vävnadsdöd eller allvarlig celldöd till följd av sjukdom, skada eller brist på blodtillförsel. Ökning av kreatinkoncentrationen kan vara ett svar på kranialcerebralt trauma. Frånvaro av kreatin kan tyda på en sällsynt medfödd sjukdom.
- Lipider : med deras huvudsakliga alifatiska toppar belägna i intervallet 0,9–1,5 ppm, ses ökning av lipider, vilket också tyder på nekros . Dessa spektra är lätt förorenade, eftersom lipider inte bara finns i hjärnan, utan även i annan biologisk vävnad som fettet i hårbotten och området mellan hårbotten och skallen.
- Laktat : Är ett AX3-system som resulterar i en dubblett (två symmetriska toppar) centrerad omkring 1,31 ppm, och en kvartett (fyra toppar med relativa topphöjder på 1:2:2:1) centrerad omkring 4,10 ppm. Dubletten vid 1,31 ppm kvantifieras typiskt eftersom kvartetten kan undertryckas genom vattenmättnad eller skymmas av kvarvarande vatten. Hos friska försökspersoner är laktat inte synligt, eftersom dess koncentration är lägre än detektionsgränsen för MRS; närvaron av denna topp indikerar emellertid att glykolys har initierats i en syrebrist miljö. Flera orsaker till detta inkluderar ischemi , hypoxi , mitokondriella störningar och vissa typer av tumörer.
- Myo-inositol : med sin huvudsakliga topp vid 3,56 ppm har en ökning av Myo-inositol setts vara störd hos patienter med Alzheimers, demens och HIV-patienter.
- Glutamat och glutamin : dessa aminosyror markeras av en serie resonanstoppar mellan 2,2 och 2,4 ppm. Hyperammonemi , leverencefalopati är två huvudtillstånd som resulterar i förhöjda nivåer av glutamin och glutamat. MRS, som används i samband med MRT eller någon annan avbildningsteknik, kan användas för att upptäcka förändringar i koncentrationerna av dessa metaboliter, eller signifikant onormala koncentrationer av dessa metaboliter.
- GABA kan detekteras främst från dess toppar vid cirka 3,0 ppm, men eftersom kreatin har en stark singlett vid 3,0 ppm med cirka 20x amplituden måste en teknik som utnyttjar J-koppling användas för att exakt kvantifiera GABA. De vanligaste teknikerna för detta är J-difference editing (MEGA) eller J-resolved (som används i JPRESS)
- Glutation kan också detekteras från sin topp vid topp vid 3,0 ppm, men likt GABA måste det också använda en metod som utnyttjar J-koppling för att ta bort den överliggande kreatinsignalen.
Begränsningar för MRS
Den största begränsningen för MRS är dess låga tillgängliga signal på grund av den låga koncentrationen av metaboliter jämfört med vatten. Som sådan har den i sig dålig temporal och rumslig upplösning. Ändå kan ingen alternativ teknik kvantifiera metabolism in vivo icke-invasivt och därmed förblir MRS ett värdefullt verktyg för forskning och kliniska forskare.
Dessutom, trots senaste ansträngningar mot internationell expertkonsensus om metodiska detaljer som shimming, rörelsekorrigering, spektralredigering, spektroskopisk neuroimaging, andra avancerade inhämtningsmetoder, databearbetning och kvantifiering, applicering på hjärnan, protonspektroskopitillämpning på skelettmuskler, fosforapplicering på skelett. muskel, metodbeskrivning, resultatrapportering och andra överväganden, för närvarande publicerade implementeringar av in vivo magnetisk resonansspektroskopikluster i litteraturer som uppvisar ett brett utbud av individualiserade insamlings-, bearbetnings-, kvantifierings- och rapporteringstekniker. Denna situation kan bidra till en låg känslighet och specificitet av t.ex. in vivo protonmagnetisk resonansspektroskopi för störningar såsom multipel skleros , som fortsätter att falla under kliniskt fördelaktiga trösklar för t.ex. diagnos.
Icke-proton ( 1 H) MRS
31 Fosformagnetisk resonansspektroskopi
1 H MRS kliniska framgång konkurreras endast med 31 P MRS. Detta beror till stor del på den relativt höga känsligheten för fosfor-NMR (7 % av protonerna) i kombination med ett 100 % naturligt överflöd. Följaktligen förvärvas högkvalitativa spektra inom några minuter. Även vid låga fältstyrkor erhålls stor spektraupplösning på grund av den relativt stora (~30 ppm) kemiska skiftdispersionen för fosfater in vivo. Kliniskt utmärker fosfor NMR eftersom det detekterar alla metaboliter som spelar nyckelroller i vävnadsenergimetabolism och kan indirekt härleda intracellulärt pH. Fosfor-NMR utmanas dock främst av det begränsade antalet metaboliter som den kan detektera.
13 Kolmagnetisk resonansspektroskopi
I motsats till fosfor-NMR är kol-NMR en okänslig teknik. Detta beror på att 13C NMR har en låg förekomst (1,1%) och kolets låga gyromagnetiska förhållande. Denna låga förekomst beror på att 12C inte har ett magnetiskt moment, vilket gör det inte NMR-aktivt, vilket leder till att 13C används för spektroskopi. Denna låga känslighet kan dock förbättras genom frikoppling, medelvärdesberäkning, polarisationsöverföring och större volymer. Trots den låga naturliga förekomsten och känsligheten av 13 C, har 13 C MRS använts för att studera flera metaboliter, särskilt glykogen och triglycerider. Det har visat sig särskilt användbart för att ge insikt om de metaboliska flödena från 13C -märkta prekursorer. Det finns stor överlappning i vad 1 H MRS och 13 C MRS kan erhålla spektramässigt och stor anledning, i kombination med 1 H MRS:s höga känslighet, varför 13 C MRS aldrig har sett bred applikation som 1 H MRS. Se även Hyperpolariserad kol-13 MRI .
23 Natriummagnetisk resonansspektroskopi
Natrium-NMR är ökänt för sin låga känslighet (9,2 % i förhållande till protonkänslighet) och låga SNR på grund av sin låga natriumkoncentration (30 - 100 mM), särskilt jämfört med protoner (40 - 50 M). Men intresset för natrium-NMR har återinspirerats av de senaste betydande vinsterna i SNR vid höga magnetfält, tillsammans med förbättrade spoldesigner och optimerade pulssekvenser. Det finns mycket hopp för natrium-NMR:s kliniska potential eftersom detektion av onormalt intracellulärt natrium in vivo kan ha betydande diagnostisk potential och avslöja nya insikter om vävnadselektrolyshomeostas.
19 Fluormagnetisk resonansspektroskopi
Fluor NMR har hög känslighet (82 % i förhållande till protonkänslighet) och 100 % naturligt överflöd. Det är dock viktigt att notera att inga endogena 19F -innehållande föreningar finns i biologiska vävnader och därför kommer fluorsignalen från en extern referensförening. Eftersom 19F inte finns i biologiska vävnader, behöver 19F inte hantera störningar från bakgrundssignaler som in vivo 1H MRS gör med vatten, vilket gör det särskilt kraftfullt för farmakokinetiska studier. 1 H MRI tillhandahåller de anatomiska landmärkena, medan 19 F MRI/MRS tillåter oss att följa och kartlägga de specifika interaktionerna mellan specifika föreningar. in vivo 19 F MRS kan användas för att övervaka upptaget och ämnesomsättningen av läkemedel, studera metabolismen av anestetika, bestämma cerebralt blodflöde och mäta, via fluorerade föreningar ("sonder"), olika parametrar som pH, syrenivåer och metall koncentration.
Se även
- Funktionell magnetisk resonansspektroskopi av hjärnan
- Magnetisk resonanstomografi
- Magnetiseringsöverföring
- NMR
- NMR-spektroskopi