Hypertermisk intraperitoneal kemoterapi
| Hypertermisk intraperitoneal kemoterapi | |
|---|---|
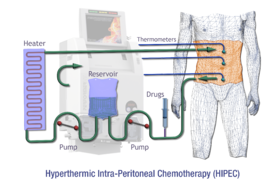 Schematisk översikt av HIPEC
| |
| Andra namn | Hypertermisk intraperitoneal kemoterapi (HIPEC), intraabdominal hyperterm kemoterapi, intraoperativ kemohypertermisk peritoneal perfusion (CHPP) eller Sugarbaker-tekniken |
| Specialitet | Kirurgisk onkologi |
Intraperitoneal hypertermisk kemooperfusion ( HIPEC eller IPHC ) är en typ av hypertermiterapi som används i kombination med kirurgi vid behandling av avancerad bukcancer. I denna procedur infunderas uppvärmda anticancermediciner och cirkuleras i bukhålan (buken) under en kort tidsperiod. De kemoterapeutiska medlen som vanligtvis infunderas under IPHC är mitomycin-C och cisplatin .
Medicinsk användning
IPHC används vanligtvis efter kirurgiskt avlägsnande av så mycket cancer som möjligt ( debulking ), vilket kan innefatta avlägsnande av alla inblandade peritoneala områden. Bevis stödjer en fördel i vissa fall av äggstockscancer .
Bevis är otillräckligt från och med 2020 för att stödja dess användning vid primär avancerad äggstockscancer, äggledare eller primär peritonealcancer, återkommande äggstockscancer, peritoneal kolorektal karcinomatos, gastrisk peritoneal karcinomatos, malign peritoneal mesoteliom av mucin, eller disseminerad bukhinne- mesoteliom .
Dessa procedurer kan vara 8–10 timmar långa och medför en betydande grad av komplikationer.
Bröstmotsvarigheten till HIPEC är den hypertermiska intratorakala kemoterapin (HITOC).
Kemoterapimedel
Olika kemoterapier används och det finns ingen tydlig konsensus om vilka läkemedel som ska användas. Mitomycin C och oxaliplatin är de vanligaste medlen för kolorektal cancer, medan cisplatin används vid äggstockscancer.
Historia
År 1934 beskrev Joe Vincent Meigs i New York ursprungligen tumördebulkingskirurgi ( cytoreduktiv kirurgi) för äggstockscancer under förutsättningen att minska makroskopisk sjukdom. På 60- och 70-talen började detta aggressiva cytoreduktiva tillvägagångssätt accepteras. Under denna tid rapporterade Dr. Kent Griffith vid National Cancer Institute också om prognostiska indikatorer för överlevnad hos patienter med stadium II och III äggstockscancer, vilket är viktigt att notera att kvarvarande tumörmassastorlek (<1,6 cm) efter cytoreduktiv kirurgi var signifikant associerad med förlängd överlevnad . Under denna tid började forskningen visa att hypertermi såväl som intraperitoneal kemoterapi var effektiv för att döda cancerceller. Spratt et al. på 1980-talet, vid University of Louisville i Kentucky kombinerade dessa koncept till ett termiskt transfusionsinfiltrationssystem (TIFS) för leverans av upphettad kemoterapi till peritonealutrymmet hos hundar. Den första människan utsattes för TIFS med administrering av hyperterm kemoterapi för lokalt avancerad abdominal malignitet 1979. Ytterligare studier på 1980-talet gav kemoterapeutiska medel i koncentrationer upp till 30 gånger högre än de som säkert administrerades via IV. I mitten till slutet av 1980-talet ledde Sugarbaker Washington Cancer Institute ytterligare undersökningar av terapi för gastrointestinala maligniteter med peritoneal spridning och kunde rapportera överlevnadsfördelar. Det blev tidigt uppenbart att fullständig cytoreduktion var förknippad med överlevnadsfördelar. 1995 Sugarbaker en stegvis metod för cytoreduktion, i ett försök att standardisera och optimera denna process.
HIPEC-tekniken förbättrades också ytterligare genom att föreslå flera leveranssätt. "Coliseum"-tekniken såväl som ett liknande tillvägagångssätt som beskrevs av Dr. Paul Sugarbaker 1999 var öppna buktekniker där uppvärmd kemoterapi hälldes in. Fördelarna med detta öppna tillvägagångssätt inkluderade direkt åtkomst av kirurgen till kaviteten under administrering av de hypertermiska medlen. att manipulera vätskan och tarmen för att uppnå en snabb och homogen temperatur och distribution av läkemedel i buken. Dessutom kan man se till att alla peritoneala ytor exponeras lika under hela behandlingen samt undvika farliga temperaturer eller överexponering för normal vävnad. Som jämförelse innebär den stängda tekniken stängning av bukväggen före infusion av kemoterapi, vilket minskar problemet med värmeförlust från bukhinnan. I försök att kombinera potentiella fördelar med dessa två tekniker använde Sugarbaker en halvöppen metod genom att utveckla ett nytt inneslutningsinstrument (Thompson-upprullare) som beskrevs 2005 för att stödja vattentät höjning av bukhudens kanter. På senare tid har ett laparoskopiskt tillvägagångssätt för CRS med HIPEC hos mycket utvalda patienter med minimal sjukdomsbörda beskrivits.
Ytterligare ett framsteg gjordes 2016, då Lotti M. et al. beskrev en ny teknik, Laparoscopy-Enhanced HIPEC (LE-HIPEC)-tekniken, där den hypertermiska kemoterapin ges efter stängningen av buksåret, och en laparoskopisk metod används för att röra om bukinnehållet under perfusionen. Lotti M ifrågasatte påståendet att Colosseum-tekniken kunde åstadkomma en homogen värmefördelning. Syftet med LE-HIPEC är att uppnå en bättre värmetillförsel och konservering (som är i den slutna tekniken) och en bättre cirkulation av perfusionsvätskan (som är i den öppna tekniken). Jämfört med standardtekniken med stängd buk, tillåter LE-HIPEC-tekniken kirurgen att öppna bukfacken för att släppa in den uppvärmda perfusionsvätskan. Dessutom tillåter det identifiering och uppdelning av de tidiga intraabdominala adhesionerna som kan hindra cirkulationen av perfusionsvätskan under en standard perfusion med sluten buk. I en ytterligare studie har Lotti M et al. visade att efter CRS förekommer tidiga intraabdominala sammanväxningar hos 70 % av patienterna, strax efter stängningen av såret.
Mekanism
Infunderad kemoterapi diffunderar från den intraperitoneala vätskan till vävnad, interstitiellt utrymme och plasma, liknande peritonealdialys . Plasma-peritoneumbarriären förhindrar systemisk absorption av kemoterapin i blodomloppet och begränsar därigenom toxicitet och biverkningar. Vissa medel, som cisplatin eller mitomycin C, värms till 41 °C-43 °C för en förstärkt cytotoxisk effekt.
Bedövningsmedel
Det har rapporterats att målinriktad terapi kan bidra till att individuellt anpassa vätsketerapi och läkemedel, vilket kan göra det möjligt att undvika överhydrering och säkerställa hemodynamisk stabilitet.
Kontrovers
Även om det är potentiellt botande, är CRS plus HIPEC associerat med betydande perioperativ sjuklighet och mortalitet och en kortvarig försämring av livskvaliteten. Skeptiker till denna procedur hävdar att det inte finns någon multicentrerad randomiserad fas 3-studie som jämför CRS+HIPEC med fullständig cytoreduktion följt av systemisk terapi. Därför har denna terapi inte uppfyllt det vetenskapliga kravet för att betraktas som standardvård. Men förespråkare för CRS+HIPEC hävdar att det hittills inte har funnits någon systemisk terapi som har gett förlängd överlevnad för peritoneala metastaser. Peritoneala metastaser, baserat på den primära tumören och sjukdomens omfattning, har en medianöverlevnad på mindre än 36 månader baserat på enbart systemisk terapi. Behandlingen av peritoneal karcinomatos av kolorektalt ursprung med cytoreduktiv kirurgi (CRS) plus hypertermisk intraperitoneal kemoterapi (HIPEC) har en 5-års återfallsfri eller botningsfrekvens på minst 16 %.