Fluorering med svaveltetrafluorid
Fluorering med svaveltetrafluorid producerar organofluorföreningar från oxiderade organiska föreningar, inklusive alkoholer, karbonylföreningar, alkylhalider och andra.
Svaveltetrafluorid är ett gasformigt reagens som kan användas för att fluorera en mängd olika organiska funktionella grupper, inklusive karbonylföreningar, alkoholer och halogenider. Behandling av karbonylföreningar omvandlar dem i allmänhet till organofluorider med ekvivalent oxidationstillstånd: karboxylsyror omvandlas till trifluormetylföreningar, ketoner och aldehyder till difluorider, etc. Reaktionen har bred räckvidd och är en av de få metoder som finns tillgängliga för direkt införande av fluor vid en specifik plats under relativt milda förhållanden.
(1)
Fluorering av alkoholer och halogenider är också möjliga med SF 4 . Emellertid är SF 4 gasformig vid rumstemperatur, och många omvandlingar som involverar detta reagens kräver förhöjda temperaturer, vilket gör hanteringen något svår. Dessutom genererar reaktionen stora mängder vätefluorid . Dessa farhågor har lett till utvecklingen av säkrare, mer robusta fluoreringsreagenser, såsom DAST ( diethylaminosulfur trifluoride) .
Mekanism och stereokemi
Rådande mekanism
Mekanismen för fluorering av SF 4 är osäker och varierar mellan substrat. Ursprungligen föreslogs alkoxisvaveltrifluorider som mellanprodukter; reaktioner av isolerade alkoxisvaveltrifluorider med vätefluorid eller upphettning har emellertid inte tillhandahållit motsvarande alkylfluorider.
(2)
Mekanismen för difluorering av vicinala dioler har varit väl etablerad och fortsätter genom inverterande attack mot en hydroxylgrupp för att ge en fluorsulfitmellanprodukt, som omvandlas till den difluorerade produkten efter en ytterligare behandling av SF 4 och HF . Den andra fluoreringen fortsätter med bibehållande av konfigurationen. Intramolekylär leverans av fluor är möjlig här och har observerats i vissa andra fall av fluorering med SF 4 . S N 1 mekanismer är operativa för föreningar som bildar karbokater lätt, medan S N 2 reaktioner äger rum med mindre joniserbara föreningar.
(3)
Fluorering av karboxylsyror ger inte bara de förväntade trifluormetylföreningarna utan även a-tetrafluorerade etrar. En mekanism för att redogöra för båda produkterna har föreslagits och experimentellt stöds. Intramolekylär leverans av fluor har åberopats för att förklara bildandet av difluormetylkatjoner. Angrepp av en molekyl av acylfluorid på en difluormetylkatjon, följt av neutralisering med in situ genererad bifluorid, leder till a-tetrafluorerade eterprodukter. Direkt reaktion med bifluorid ger trifluormetyl-innehållande produkter.
(4)
Omfattning och begränsningar
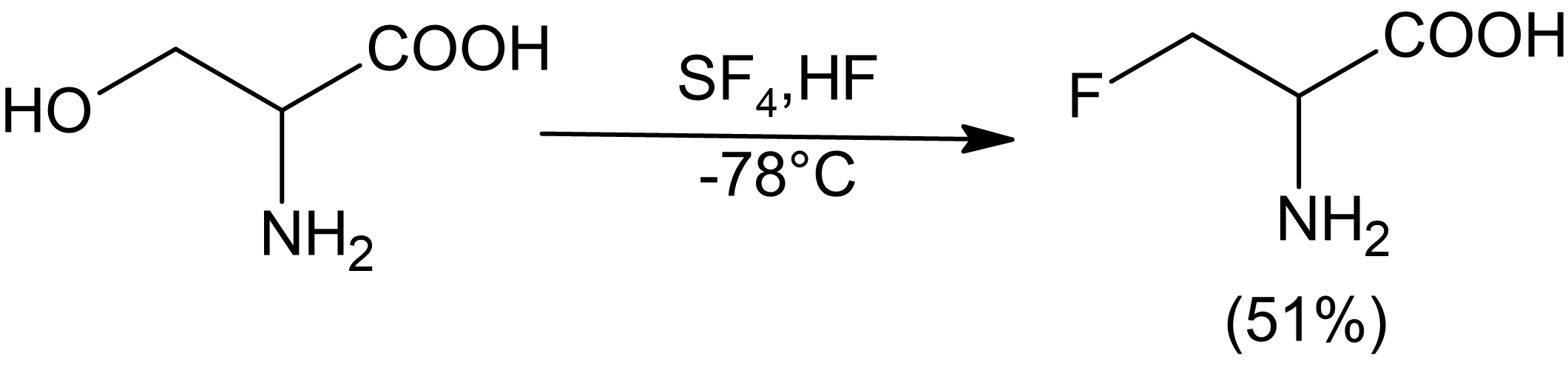
Svaveltetrafluorid kan användas för att ersätta en mängd funktionella grupper med delvis eller helt fluorerade derivat. Flytande vätefluorid kan användas som lösningsmedel och katalysator med SF 4 för att selektivt fluorera alkoholer. SF4 : s reaktivitet med karbonylföreningar förstärks inte i närvaro av HF. I allmänhet kan endast relativt sura alkoholer fluoreras effektivt med SF4, även om aminoalkoholer verkar vara ett undantag från denna regel.
(5)
När vicinala dioler kombineras med SF4 sker difluorering med inversion av konfigurationen vid en av alkoholerna. Detta visades i syntesen av meso -difluorsuccinat från (L)-tartrat och syntesen av (D)- och (L)-difluorsuccinat från meso -tartrat.
(6)
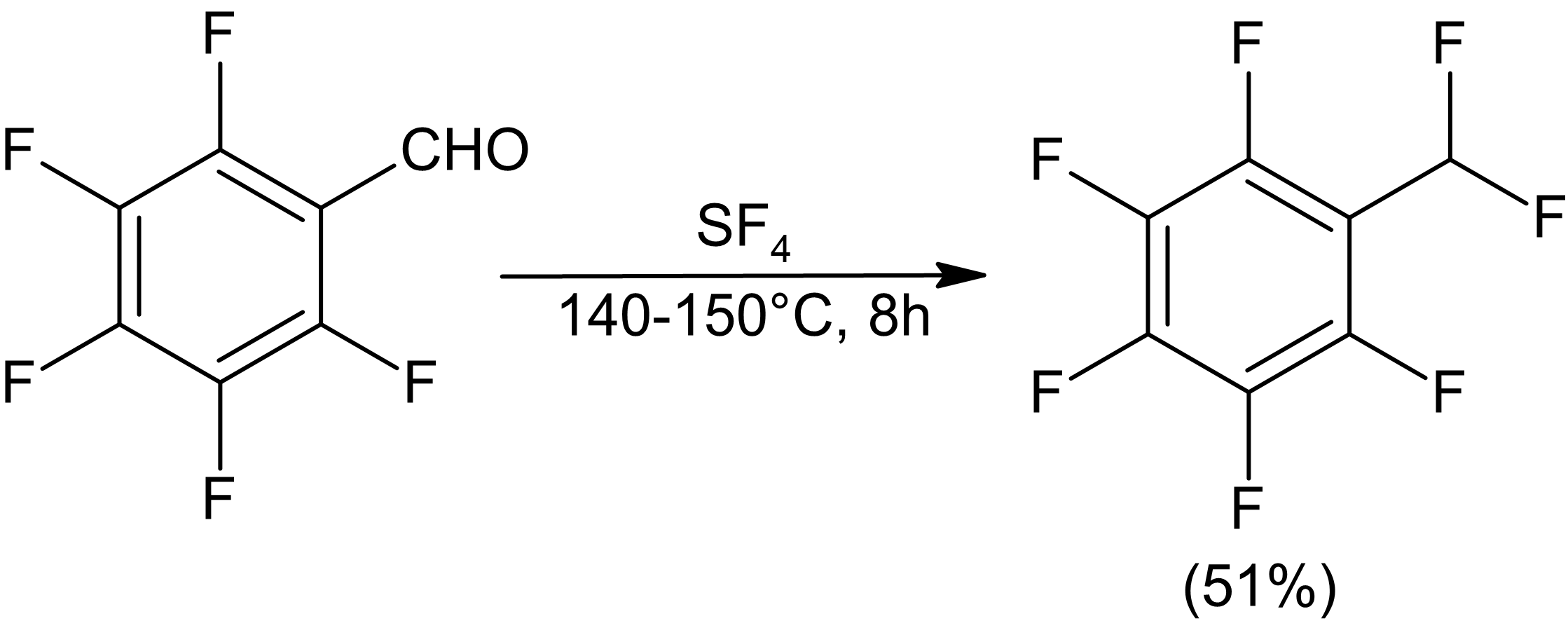
Karbonylföreningar reagerar i allmänhet med SF4 för att ge geminala difluorider. Reaktionstider tenderar att vara i storleksordningen timmar och utbytena är måttliga.
(7)
Fluorering av laktoner kan ge heterocykliska fluorider, även om ringöppning har observerats för y-butyrolakton. Den sexledade laktiden upplever inte ringöppning.
(8)
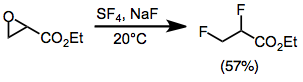
Fluorering öppnar epoxider för att ge antingen geminala eller vicinala difluorider i de flesta fall. Monoarylepoxider ger geminala produkter med migration av arylgruppen. Utbytena är låga för steriskt hindrade di- och trisubstituerade epoxider. Epoxider substituerade med en estergrupp ger vicinala difluorider via en alkoxisvaveltrifluoridmellanprodukt.
(9)
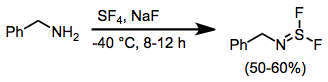
När aminer behandlas med SF 4 och en bas uppstår iminosvaveldifluorider. Ytterligare reaktion av dessa föreningar med alkalimetallfluorider leder till nitrilsulfider, som genomgår [3+2] cykloaddition i närvaro av dipolarofiler.
(10)
Karboxylsyror reagerar med SF4 för att ge trifluormetylföreningar genom en acylfluorid. Tetrafluoralkyletrar bildas också via reaktion mellan difluormetylkatjon och acylfluorid.
(11)
Svaveltetrafluorid kan användas för att fluorera polymerer effektivt. Detta har ofta en djupgående effekt på polymeregenskaper - fluorering av polyvinylalkohol förbättrar till exempel dess motståndskraft mot starka syror och baser.
Syntetiska applikationer
Syntesen av ett prostaglandin som bär en trifluormetylgrupp vid C-16 är baserad på en intermediär erhållen genom fluorering av en karboxylsyra med svaveltetrafluorid.
(12)
Jämförelse med andra metoder
Moderna fluoreringsmetoder har gjort svaveltetrafluorid väsentligen föråldrad. Användning av det mer lätthanterliga reagenset DAST ( dietylaminosvaveltrifluorid ) är nu att föredra framför SF 4 för nukleofila fluoreringsreaktioner. DAST är mer selektivt vid fluorering av alkoholer och främjar färre omarrangemang och eliminering i syrakänsliga substrat. Olägenheten med att hantera gasformig SF4 är en nackdel med fluorering som använder detta reagens. Dessutom kan syralabil funktionalitet inte finnas i substratet om HF används. Elektrofila fluorerande reagens, såsom Selectfluor och N -fluorosulfonimider, kompletterar reaktiviteten hos SF 4 och undviker dessa problem.
(13)
Experimentella villkor och tillvägagångssätt
Typiska förhållanden
Svaveltetrafluorid är en färglös gas vid rumstemperatur, även om den kokar vid -38 °C. Det hydrolyseras snabbt i vattenhaltiga medier och är frätande och giftigt; reaktioner bör därför utföras i ett välventilerat dragskåp med handskar och skyddsglasögon. Svaveltetrafluorid reagerar inte med rostfritt stål, koppar eller nickel. utförs fluoreringsreaktioner med SF4 i en skakapparat av rostfritt stål. Gasformiga reagenser införs i skakaren genom kondensation och gasformiga produkter ventileras vanligtvis när reaktionen är fullbordad (såvida inte de gasformiga produkterna är av intresse, i vilket fall de kan kondenseras till ett separat kärl). Vätefluorid kan separeras från de önskade produkterna genom att hälla reaktionsblandningen i vatten följt av filtrering. Lösningar av kalciumhydroxid kan också användas i detta sammanhang som ger ofarlig kalciumfluorid .
Exempel tillvägagångssätt
(14)
5-hydroxihistamin-dihydroklorid (1700 mg, 3,5 mmol) löstes i 25 ml vattenfri flytande HF och lösningen indunstades i en ström av torrt kväve för att avlägsna HCl. Återstoden återupplöstes i 40 ml HF vid -78°C, behandlades med 2,3 ml SF4 ( 40,3 mmol) och värmdes till 0°C under 2,5 timmar. Efter återkylning till -78"C kondenserades ytterligare 2 ml SF4 i lösningen. Reaktorn nedsänktes sedan i ett isbad (ca. 1 L) som fick värmas till rumstemperatur över natten. HF:n avlägsnades i en ström av N2 , återstoden löstes i 25 ml 2,5 N HCl och lösningen koncentrerades i vakuum till en gummiartad återstod.Detta applicerades på 150 ml Dowex 50X8 och eluerades med 200 ml H2O 400 ml 1 N HCl och ca 1 L 2,5 N HCl. De ninhydrinpositiva fraktionerna (2,5 N HCl) koncentrerades till 500 mg kristallin B-fluorhistamin-dihydroklorid (71%): sönderdelning vid 130 °C när den infördes vid denna temperatur: 60 MHz ^ H NMR (D2O - DCl) 5 3,3-4,2 (bred multiplett, 2H), 6,27 (dubbel av fyrradiga multipletter, 1H, JHF = 47 Hz), 7,83 (m) Analys beräknat för C5H10N3FC12 : C , 29,70 , H , 4,95, N , 20,80, F, 9,40. Funnet: C, 29,69, H, 4,94, N, 20,51, F, 9,72.